|
Im Grunde müssen wir nur vier grundsätzliche
Polarisationsmechanismen anschauen: |
|
 |
Grenzflächenpolarisation
.
Grenzflächen wie Korngrenzen, Phasengrenzen usw. sind oft geladen und enthalten unkompensierte Dipole –
schon weil es zum Beispiel in Ionenkristallen gar nicht anders geht. Wer's nicht glaubt, betätigt diesen Link. |
|
 |
Atompolarisation (manchmal auch elektronische Polarisation genannt).
Ein elektrisches Feld zieht immer die "Elektronenwolke"
eines Atoms in eine Richtung, und den Atomkern in die andere. Als Effekt liegen die Ladungsschwerpunkte nicht mehr aufeinander
– ein elektrisches Dipolmoment wird induziert. |
|
 |
Ionische Polarisation.
In diesem Fall muss
die Bindung einen ionischen Anteil haben, d. h. die Atome sind mehr oder weniger geladen. Was dann im Prinzip passiert,
haben wir uns schon angeschaut: Die vorhanden Dipole werden größer
oder kleiner, heben sich also nicht mehr perfekt gegenseitig auf. Es wird ein Netto-Dipolmoment induziert. |
|
 |
Orientierungspolarisation
.
Sie funktioniert mit elektrischen Dipolen erstmal nur bei Flüssigkeiten,
die aus "polaren" Molekülen bestehen, d. h. aus Molekülen mit einem festen Dipolmoment, wie z. B. H2O.
In einer Flüssigkeit kann sich das Dipolmoment mit dem Molekül in alle mögliche Richtungen drehen. Bei Wasser
ohne elektrisches Feld mit wild herumwirbelnden Wassermolekülen werden auch alle Richtungen mit gleicher Wahrscheinlichkeit
vorkommen. Mit elektrischem Feld werden die Dipolmomente alle etwas in Feldrichtung gedreht; wiederum wird ein Netto-Dipolmoment induziert.
|
 |
Das war's im Großem und Ganzen. Der 4. Mechanismus, die Orientierungspolarisation, interessiert uns hier aus zwei
Gründen, obwohl wir uns sonst eher nicht mit Flüssigkeiten abgeben: |
| |
- Er ist in (mathematisch) exakt identischer Weise der wichtigste Mechanismus wenn wir nicht elektrische, sondern magnetische
Dipole anschauen, d.h. magnetische Materialien betrachten. Deshalb nehmen wir ihn hier mal mit.
- Er steckt hinter dem, was in der "Mikrowelle" so passiert. Und das sollte
der ET&IT-Ing. seinem Gspusi oder der Verwandschaft schon erklären können.
|
 |
Jetzt schauen wir uns diese Mechanismen noch etwas im Detail an: |
| |
|
|
Grenzflächenpolarisation
|
| |
|
 |
Grenzflächenpolarisation ist wichtig, aber kann nicht einfach berechnet werden
– sie hängt halt von vielen Dingen ab. |
|
 |
Dielektrika mit großer Suszeptibilität bzw. Dielektrizitätskonstanten
in "billigen" Kondensatoren nutzen die Grenzflächenpolaristion in zusammengesintertem Zeugs mit kleinen Körnern
und daher vielen Grenzflächen. |
|
 |
Sie sind "billig", weil ihr Frequenzverhalten, Durchbruchsverhalten und sonstige
Qualitätsmerkmale nicht spitze sind. Und das liegt auch am Dielektrikum! |
|
 |
In integrierten Schaltungen sind Ladungen an den vielen Grenzflächen – die Ursache
für die Grenzflächenpolarisation – oft absolut tödlich. Ein Großteil der Forschung und Technik
im Bereich Mikroelektronik oder Solarzellen dreht sich um dieses Phänomen, das dann allerdings üblicherweise unter
anderen Bezeichnungen läuft. |
 |
Mehr dazu brauchen wir erst mal nicht zu wissen. |
|
|
|
Atompolarisation |
| |
|
 |
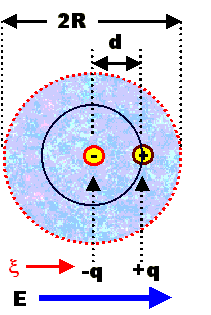
Wenn wir ein stark vereinfachtes sphärisches Atom in ein elektrisches Feld
stecken, bekommen wir sowas: |
|
| |
| |
|
 |
Die Elektronenhülle hat's etwas nach links, den Atomkern etwas nach rechts gezogen, die
Ladungsschwerpunkte liegen jetzt um ein x auseinander – damit ist ein Dipolmoment
z · e · x induziert
worden (z = Ordnungszahl, e = Elementarladung). |
| | |
 |
Das äußere Feld E zieht die Ladungen auseinander, die innere Coulombwechselwirkung
zieht sie zurück – ganz so, als ob die Ladungen durch eine Feder
gekoppelt wären. Das Kräftegleichgewicht bestimmt, wie groß x sein
wird. Ohne groß zu rechen, können wir für x << R (d. h. sehr
viel kleiner als die Atomgröße) annehmen, dass x
µ E sein wird. |
| | |
 |
Damit können wir drei wichtige Schlussfolgerungen
ziehen: - Atompolarisation funktioniert immer
. Ein Teil der Suszeptibilität bzw. Dielektrizitätskonstante jedes
Materials kommt von diesem Polariationsmechanismus.
- Wir haben (was wir ja wollten) "bewiesen", dass für die Atompolarisation
P µ E gilt.
- Wir haben außerdem den Frequenzgang schon im Prinzip bestimmt: Wenn wir ein elektrisches Wechselfeld mit der Kreisfrequenz
w = 2pn
anlegen, wackeln wir periodisch an einer kleinen Masse (die der Elektronenwolke), die über eine Feder an einem
sehr schweren Gegenstand (dem Atomkern) hängt. Bei irgendeiner Frequenz sollte dann Resonanz
auftreten – die Schwingungsamplitude wird groß!
|
| | |
| |
 |
Wie wichtig ist die Atompolarisation in der Praxis? Anders gefragt, bei welchen
Materialien ist die Suszeptibilität / Dielektrizitätskonstante
überwiegend durch diesen Mechanismus bestimmt? |
|
 |
Wir merken uns nur zwei Punkte dazu:
- Bei halbwegs sphärischer Verteilung der Elektronen um ein Atom ist der Mechanismus sehr
schwach
. Die Dielektrizitätskonstante der Edelgase ist z. B. nur unwesentlich größer als 1.
- Bei nicht-sphärischer Verteilung der Elektronen, wie z. B. in den kovalenten
Bindungen aller relevanten Halbleiter, ist der Effekt sehr
stark!
|
|
| |
| |
Die Suszeptibilität / Dielektrizitätskonstante
von Halbleitern wie Silizium
kommt überwiegend von der Atompolarisation |
er(Si) = 12
er(Ge) = 16 |
|
| |
|
|
Ionische Polarisation |
| |
|
 |
Dieser Polarisationsmechanismus wirkt primär in Ionenkristallen wie NaCl
oder LiF, aber auch in allen Kristallen mit ionischer Komponente wie SiO2
oder so gut wie allen anderen Oxiden (die Sauerstoffatome binden die Elektronen fast immer etwas fester als der Rest, sind
also netto etwas negativ geladen). |
|
 |
Wie zuvor gilt: Das Feld zieht die vorhandenen Dipole auseinander oder drückt
sie zusammen – es wird ein Netto-Dipolmoment induziert. Das Feld zieht oder drückt dabei gegen die "Bindungspotentialfeder"! |
|
 |
Aha – das haben wir gehabt!
Die "Federkonstante
" einer Bindung war Y · a, mit Y = Elastizitätsmodul,
wie wir ihn hier nach englischem Vorbild ("Youngs Modulus")
nennen wollen, um Verwechslungen mit dem Buchstaben "E" für das elektrische Feld auszuschließen;
a ist der Bindungsabstand oder ungefähr die Gitterkonstante. |
|
 |
Wir können damit sogar berechnen,
mit welcher Kraft F an einem Ion mit Ladung q gezogen und bei welcher Auslenkung x
Kräftegleichgewicht herrschen wird. Wir haben (immer nur mit Beträgen der Kräfte) |
| |
| Feldkraft auf Ladung: |
Felek | = |
q · E |
| | |
| |
| Rückziehende Bindungsfederkraft: |
F Bindg | = |
Y · a · x |
| | |
| |
| Kräftegleichgewicht zur Auslenkung x |
Y · a · x |
= | q · E |
| | |
| |
| Þ Auslenkung |x| |
|x| |
= | q · E
Y · a | |
|
|
 |
Damit können wir jetzt hergehen und im Prinzip die DK oder die Suszeptibilität von Ionenkristallen berechnen. |
|
 |
Tun wir aber nicht, sondern nehmen nur zur Kenntnis: Der Effekt kann groß sein; Ionenkristalle
haben verhältnismäßig große Suszeptibilitäten, siehe die Tabelle. |
 |
Was aber auch ohne Übung jetzt klar sein sollte: Im dielektrischen Verhalten
der Materie steckt schon jetzt die "Mechanik" und "Thermodynamik" – Bindungspotentiale, Elastizitätsmodul,
mittlere Geschwindigkeiten – wir haben das alles nicht nur aus Jux und Tollerei gelernt! |
| |
|
|
Orientierungspolarisation
|
| |
|
 |
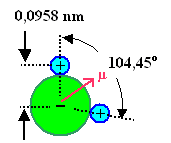
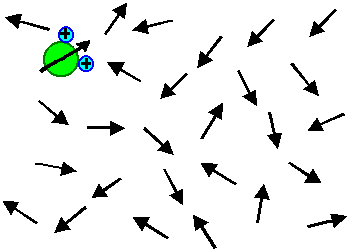
Das Modell für diesen Polarisationsmechanismus ist Wasser – H2O.
Schauen wir uns das "Wasserbild" noch mal genauer an: |
| |
|
 |
Was wir sehen, ist eine Momentaufnahme
mit ganz kurzer Belichtungszeit. Die Wassermoleküle sind
in ständiger Bewegung – sie laufen und rotieren; wir wissen
im Prinzip sogar wie schnell! Ja? OK – Zeit für eine Übung. |
| |
|
|
 |
Das Dipolmoment eines Wassermoleküls ist übrigens 1,84 Debye.
(1 Debye = 3,33564 · 10–30 Cm; warum soll immer nur ich blöde alte Zahlenangaben umrechnen?
Mach's mal selber!) |
 |
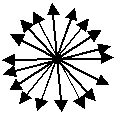
Die wassereigenen Dipole führen also einen rasenden Tanz auf: Ihr Dipolmoment
macht einen "random walk" bezüglich der Richtung
und des Ortes. Die Vektorsumme aller Dipolmoment wird sich sehr exakt zu Null addieren. |
|
 |
Schalten wir jetzt ein elektrisches Feld ein, wird der Dipol versuchen, sich in Feldrichtung
auszurichten, denn daduch gewinnt er Energie. Anders ausgedrückt. Sein pos. Kopf will sich so nahe als möglich
zum negativen Feldpol orientieren, denn er wird von ihm angezogen, sein negativer Hintern aus denselben Gründen zum
Positivpol. Dazu muss der Dipol rotieren. |
|
 |
Dazu hat er aber nicht viel Zeit. Sobald das Molekül wieder mit einem Kollegen kollidiert,
haut's den Dipol wieder in eine Zufallsrichtung. |
|
 |
Der Nettoeffekt bei realen Flüssigkeiten und realen Feldstärken
(maximal um 10 MV/cm) ist einerseits sehr klein, d. h. die Vektorsumme ist nur leicht von Null verschieden, anderseits
groß genug, um große Suszeptibilitäten zu machen – Wasser hat schließlich eine Dielektrizitätskonstante
von um die 80! Es sieht schematisch etwa so aus: |
| |
 |
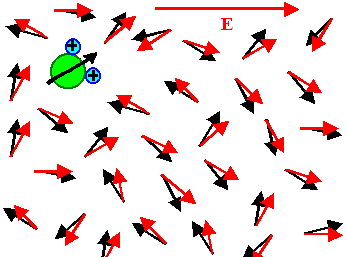 |
| Ohne Feld | Mit Feld |
|
 |
Die Berechnung der Orientierungspolarisation ist zwar nicht besonders schwierig,
aber mathematisch durchaus trickreich. Was wir tun müssen, ist klar: Wir minimieren
wie immer einfach die freie Energie des Systems, um den Gleichgewichtszustand zu finden. |
|
 |
Die Ausrichtung der Dipole im Feld "bringt" Energie, aber "kostet" Entropie, denn ein
System mit ausgerichten Dipolen ist zweifelsohne ordentlicher als eines mit statistisch verteilten Dipolen. Wer wissen will,
wie's geht, betätigt den Link. |
|
 |
Was rauskommt, ist: |
| |
| P | = |
NV · <m> |
= |
NV · m · L(b) |
| | |
| | |
| L(b) | = |
coth (b ) – |
1
b |
| | | |
| | |
| b | = |
m · E
kBT |
| |
|
|
|
|
 |
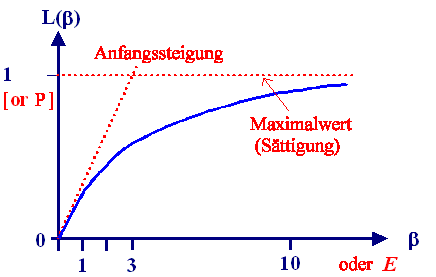
L(b) heißt Langevin-Funktion
, sie kommt in Problemen dieser Art häufig vor. Die Größen sind NV
= Dichte der Dipole (d. h. der Wassermoleküle), <m> = Vektormittel der
Dipolmomente, also P / NV. Das Ganze sieht so aus: |
| |
|
|
 |
Die Kurve zeigt quantitativ L(b); durch einfaches Umskalieren
der Achsen erhält man aber exakt dieselbe Kurve für die Polarisation als Funktion der Feldstärke. |
 |
Bei realistischen Feldstärken (unter ca. 10 MV/cm) und Temperaturen
liegt man ganz in Anfangsbereich der Kurve – zwischen b = 0 und b
< 1. |
|
 |
Per Reihenentwicklung usw. bekommt man als gute Näherung für die
mittlere Polarisation P: |
|
|
|
|
 |
Der Faktor N · m2 / (3kBT)
wäre also die Suszeptibilität
c = e
r – 1 multipliziert mit der Vakuumpermittivität e
0
. Wir haben damit im Prinzip die Dielektrizitätskonstante von Wasser ausgerechnet und außerdem gezeigt, dass
in guter Näherung die Polarisation proportional zur Feldstärke ist. |
|
 |
Wir haben auch verstanden, warum eine bisher rein elektrische Größe wie die DK
jetzt "plötzlich" temperaturabhängig wird! |
| | |
© H. Föll (MaWi für ET&IT - Script)