|
Kovalente Bindungen in Reinkultur liegen
vor, wenn zwei Atome, die beide zu wenig Elektronen haben, den Mangel teilen und sich
verbinden. Beispiele sind ... |
|
 |
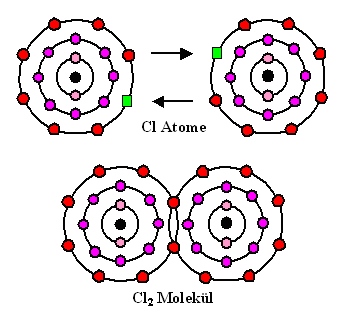
... die Halogenide in Gasform: F2,
Cl2 , Br2, usw. |
|
 |
... viele typischen Gase : O2
, N2, NH3 (Ammoniak), CO2 , usw. |
|
 |
... Festkörper wie z.B. Si, Ge, C
(in der Form des Diamanten), GaAs (Galliumarsenid) und andere. |
 |
Das Grundprinzip ist immer dasselbe: Die Atome teilen
sich den Mangel; dabei geht es ihnen energetisch viel besser, als wenn jedes
seinen Elektronenmangel alleine bewältigen muß. |
|
 |
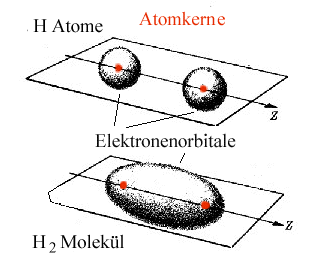
Als Beispiele schauen wir uns das Wasserstoff- und Chlormolekül an, danach typische Halbleiter: |
|
|
|
 |
Wie auch immer das im obigen Bild im Detail abläuft – erkennbar ist,
daß die Bindung zunächst
ungerichtet ist. Nach dem Zusammengehen mit einem Partner ist aber keine
Lust für weitere Bindungen mehr vorhanden (oder korrekt gesagt: es gibt keine freien Valenzen mehr).
|
|
 |
Wir beschreiben deshalb die Bindung mit der richtige Anzahl von "Bindungsarmen".
Zahl Bindungsarme = Zahl freier Valenzen. |
|
 |
Wir können mit nur einemBindungsarm, d. h. wenn dem
prospektiven Partner zu seinem Glück nur ein Elektron fehlt, ganz klar keine Kristalle
bekommen – das hatten wir schon. |
 |
Den für uns spannenden Elementen Si, Ge, Ga, As,
N, P (nicht zu vergessen: C) fehlen aber 4 (bzw. 3 oder 5) Elektronen, und deswegen bieten sie
geeigneten Partnern auch 4 (bzw. 5 oder 3) Elektronen zum Teilen an. |
|
 |
Sobald ein geeigneter Partner in der Nähe ist – von der eigenen Art oder auch ein
sonst passender (aber nicht jeder!) –, reorganisieren sie ihre Elektronenschar so, daß 4 Elektronen sich
bevorzugt in den 4 Tetraederrichtungen
anordnen und sich in den unten gezeigten Keulen aufhalten, die den schönen Namen
sp3-Hybridorbitale tragen. |
| |
|
|
 |
Mit diesen Keulen haben wir vier klar defiinierte Bindungsarme. Was passiert,
wenn sich jetzt viele der Atome zusammentun, hatten wir auch schon; es ist oben
nochmals gezeigt. Falls alle Atome von derselben Sorte sind, hätten wir Diamant (=Kohlenstoff
C), Silizium (Si) Germanium (Ge) usw.; die Kristallstruktur heißt in allen Fällen Diamantstruktur.
Mit zwei Atomsorten wird es die Zinkblendestruktur, und die betrifft (neben dem namensgebenden ZnS) insbesondere
GaAs, GaN, InP, GaP, ... – alle ziemlich wichtig für die ET&IT.
|
|
 |
Für das Bindungspotential sind jetzt nicht nur alle vier
Parameter unbekannt, diese Parameter sind auch noch richtungsabhängig. Soweit es
uns hier betrifft können wir für weiterführende Rechnungen also nur konstatieren:
Forget it!
|
 |
Was können wir noch über Eigenschaften der kovalenten Bindung lernen? |
|
 |
Sie kann in mehreren Arten vorkommen. Das müssen wir zwangsweise annehmen,
denn reiner Kohlenstoff (C) liegt in der Regel ja nicht als Diamant vor, sondern als Graphit.
Das sieht so aus: |
| |
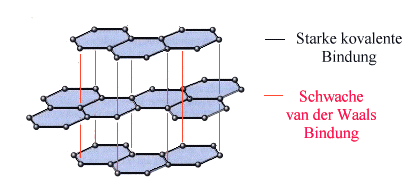 |
| Graphitstruktur |
|
|
 |
Jedes Kohlenstoffatom hat nur drei
koplanare Bindungsarme, kann also nur hexagonale Schichten bilden, wie schon mal prinzipiell
gezeigt. Eigentlich kann man damit gar keinen dreidimensionalen Kristall bilden, aber die Schichten halten passend übereinandergelegt
auch noch ein bißchen zusammen - über die sogenannten sekundären
Bindungen. |
 |
Jetzt haben wir eine Menge Fragen (und Antworten):
- Warum macht der Kohlenstoff (und andere Atome) sowas? Einfach: Weil es prinzipiell möglich ist.
- Warum macht Kohlenstoff aber viel lieber Graphit als Diamant? Weil die Energieabsenkung
für einen Haufen Kohlenstoffatome bei der Bildung von Graphit größer ist als bei der Bildung von Diamant.
- Warum wandeln sich dann die (bei hohem Druck und Temperatur) irgendwie enstandenen Diamanten nicht spontan in Graphit
um? Weil man erst Energie hineinstecken muß, damit man den durch die Umwandlung enstehenden Energiegewinn realisieren
kann. (Wie im richtigen Leben! Wir (oder ein Stück Holz) verbrennen auch nicht spontan, obwohl das energetisch günstig
wäre. Man müßte uns schon "anzünden" = Energie zuführen.)
- Gibt es Si usw. auch in Graphitform? Nein. Ist zwar prinzipiell möglich, aber energetisch so ungünstig,
daß es nie passiert.
|
 |
Wir erkennen: Mit kovalenten Bindungen kann man einiges veranstalten (z.B. Kohlenstoffketten
und damit Sie, verehrte Leserin / Leser). Trotz der ungeheuren möglichen Vielfalt kann man aber ein paar allgemeine
Schlüsse ziehen: |
|
 |
Kovalent gebundene Kristalle sind typischerweise Isolatoren
- zumindest bei sehr tiefen Temperaturen. Denn sie haben erst mal keine freien Elektronen. |
|
 |
Halbleiter sind aber auch kovalent gebunden, müssen aber ja wohl ein paar
freie Elektronen haben. Ja - aber nur bei Temperaturen, die hoch genug sind, um per thermischer Energie kBT
(oder Lichtenergie hn) einige wenige Elektronen aus ihren Bindungen zu reißen! |
|
 |
Kovalent gebundene Kristalle sind durchsichtig für Licht mit einer Energie
h n, die kleiner ist, als die Energie, die benötigt wird, um Elektronen aus Bindungen
zu reißen. So ist es! Diamanten sind durchsichtig für sichtbares Licht, Si ist durchsichtig bis zum nahen
IR. |
|
 |
Kovalente Bindungen sind stark – Schmelzpunkte sind eher hoch, E-Module
sind eher hoch, die Bindung bricht nicht so schnell, usw. |
 |
So weit, so gut. Langsam wird aber klar, daß wir, um Halbleiter zu verstehen,
doch noch etwas genauer auf die Elektronen in ihren Orbitalen schauen müssen – wir brauchen etwas Quantentheorie! |
| |
|
 |
Hier die Aufgaben: |
|
|
|
© H. Föll (MaWi für ET&IT - Script)