 |
Wir haben noch den Fall zu behandeln, daß die Atome, die sich verbinden
wollen, zuviele
Elektronen haben. Damit kommen wir zur Metallbindung. |
 |
Was dann geschieht, zum Beispiel wenn sich metallisches Natrium bildet, ist einfach zu beschreiben, aber sehr schwer zu berechnen (wir
werden aber im Rahmen der Bändertheorie noch teilweise darauf zurückkommen): |
|
 |
Die Atome geben ihre überschüssigen Elektronen einfach an den entstehenden
Festkörper ab; es entsteht eine Art Elektronengas innerhalb des Körpers. In
diesem negativ
geladenen Elektronengas sitzen die positiv geladenen "Ionenrümpfe"
wie die Rosinen im Teig. Obwohl sich die Ionen abstoßen, vermittelt das negativ geladenen Kontinuum des Elektronengases
eine Bindungskraft. |
 |
Betrachten wir zunächst Na-Dampf,
so sehen wir (im Bild unten) einzelne Atome, die ohne viel gegenseitige Wechselwirkung
wild durcheinander fliegen. |
|
 |
Es bilden sich keine
Na-Moleküle, wie etwa beim Cl, denn die Na-Atome haben durch Bindungen mit nur einem oder wenigen
Na-Partnern nichts zu gewinnen. |
|
 |
Allenfalls werden wir ein paar Ionen und entsprechend
viel einzelne freie Elektronen finden. |
|
|
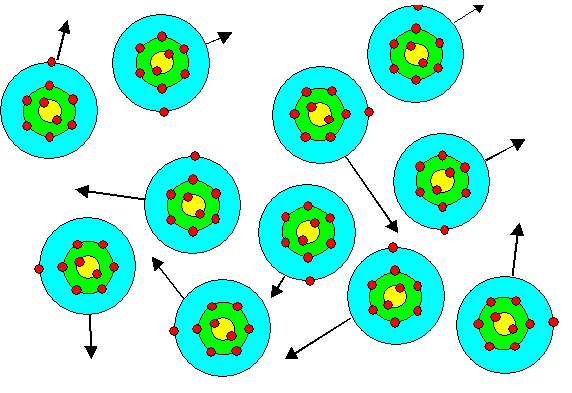 |
Schalenbild von (großen) Na-Atomen im Dampf. Die Atome
befinden sich
in lebhafter Bewegung; angedeutet durch Pfeile. |
|
 |
Aber beim Abkühlen der vielen Na-Atome bildet sich irgendwann metallisches Na, vermittelt durch die Metallbindung, die nur im Verbund sehr vieler Atome
wirkt. Die Na-Ionen sitzen in dann regelmäßiger Anordnung in ihrem Elektronengas; allenfalls die Atome
an der Oberfläche des festen Körpers haben Probleme. |
| |
 |
Kleine Na-Ionenrümpfe, eingebettet in das negativ
geladenene (rosa) Elektronengas.
Die Atome sitzen im Mittel fest auf ihren Plätzen,
ansonsten vibrieren sie
um die Gleichgewichtslage.
Die Elektronen sind frei beweglich und nicht mehr einzelnen
Ionen zugeordnet,
sie rennen "statistisch" in der Gegend herum. |
|
 |
Wie ist das mit den Eigenschaften? |
|
 |
Die Bindung sind ungerichtet - wir erwarten Kristalle mit dichtester
Kugelpackung. |
|
 |
Wir haben je nach Metall 1 bis ca. 4
freie Elektronen pro Atom. Das ist eine ganze Menge! Die Metallbindung produziert
damit elektrische Leiter. |
|
 |
Metalle sind undurchsichtig, denn Photonen finde jede Menge Elektronen, an die
sie ihre Energie in beliebiger Höhe übertragen können. |
|
 |
Die Bindungsstärke variiert stark, je nach Atomsorte. Bei Quecksilber (Hg)
ist sie so gering, dass der Schmelzpunkt unterhalb von Raumtemperatur liegt; bei Wolfram (W), Ta usw. liegt er dafür extrem hoch.
|
| | |
|
 |
Hier die Fragen: |
|
|
|
© H. Föll (MaWi für ET&IT - Script)

