 |
Während Sie das lesen, hat Ihr Körper unzählige Bindungen zwischen
einigen seiner Atome und Moleküle gelöst und dafür andere neu geschlossen. Wenn sich nichts ändert,
passiert auch nichts. Leben, was immer das ist, beruht darauf, dass auch schon bei Raumtemperatur
eine Menge Chemie ablaufen kann – und das heißt, dass Bindungen sich lösen und neue eingegangen werden. |
|
 |
Leben beruht unter anderem auch darauf, dass bei Raumtemperatur TRT
» 300 K einige Bindungen total stabil sind, insbesondere die C-C-Bindung. Die
stabilen Bindungen kennen wir schon, aber welche Bindungen haben Energien, die so klein sind, dass bei TRT
was passieren kann? |
|
 |
Die Anwort heißt: Die sekundären Bindungen.
Sie führen dazu, daß sich z. B. die folgenden festen Substanzen bilden können:
- Edelgas-Kristalle (gibt es für alle Edelgase außer He bei sehr
tiefen Temperaturen). Eigentlich haben die Edelgase überhaupt keinen Grund, Bindungskräfte zu entwickeln - sie
müßten auch noch bei sehr tiefen Temperaturen gasförmig sein.
- Eis (gefrorenes Wasser). Was führt zu Kräften zwischen den H2O-Molekülen,
die eigentlich keine Bindungsarme mehr frei haben?
- DNS. Was hält die beiden Spiralen der Doppelhelix zusammen - aber nur so stark,
daß die Bindungen wie in einem Reißverschluß bei der Zellteilung leicht zu öffnen sind?
|
 |
Eine der beiden wichtigsten Sekundärbindungen heißt nach ihrem "Entdecker"
Van-der-Waals-Bindung.
Die Van-der-Waals-Bindung kommt von den anziehenden Kräften zwischen günstig orientierten elektrischen
Dipolen. Zwei Fälle müssen unterschieden werden: |
|
 |
1. Betrachten wir Moleküle, die von Haus aus Dipolcharakter haben, d.h. in denen
die Ladungsschwerpunkte der beteiligten Atome nicht aufeinander liegen, wird es bei entsprechender Orientierung ein anziehendes
Potential geben, das mit 1/r 6 abfällt. |
|
 |
2. Aber auch Atome oder Moleküle, die von Haus aus kein Dipolmoment haben – z.B. Edelgasatome
–, haben nur im zeitlichen Mittel
keinen Dipolcharakter. Momentan jedoch werden die Elektronen nicht kugelsymmetrisch
verteilt sein, sondern ihr Ladungsschwerpunkt wird um die Kernposition herum fluktuieren. |
|  |
Und ein solcher momentaner Dipol kann ein benachbartes Atom etwas polarisieren – d.h. ein kleines Dipolmoment induzieren. Im Endeffekt entwickelt sich eine
sehr schwache anziehende Kraft zwischen die den induzierten Dipolen, die wiederum mit
1/r 6 abfällt. |
 |
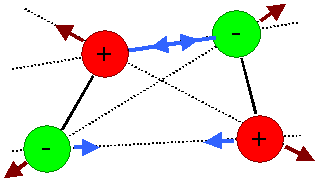
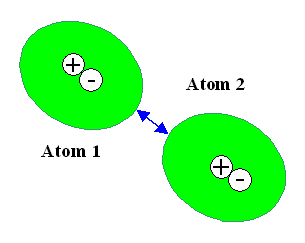
Beide Möglichkeiten sind hier schematisch gezeigt: |
| |
 |
 |
Zwei elektrische Dipole und die
einzelnen abstoßenden
und anziehenden Kräfte.
Bei der gezeigten Orientierung überwiegen
die anziehenden Kräfte. |
Das momentan polarisierte Atom 1 – der
negative Ladungsschwerpunkt
der (grünen)
Elektronenwolke liegt neben dem pos. Ladungs-
schwerpunkt des Atomkerns – ruft in dem benachbarten
Atom 2 durch elektrostatische Wechselwirkung
eine entgegengesetze Polarisation hervor. Es resultiert eine
schwache anziehende Kraft. |
|
 |
Zu 2.: Es bleibt noch die sogenannte Wasserstoffbrückenbindung
zu besprechen. Sie sorgt nicht nur in vielen biologischen Molekülen für den Zusammenhalt zwischen Teilbereichen,
sondern ist insbesondere für die Bildung von Eis (=gefrorenes H2O ) verantwortlich. |
|
 |
Am einfachsten stellt man sich die Wasserstoffbrückenbindung
als eine Unterart der Ionenbindung vor. Obwohl der Wasserstoff normalerweise kovalente Bindungen eingeht, wird er im
Gespann mit extrem "elektronegativen" Atomen – z.B. F, O und N – seines einzigen
Elektrons mehr oder weniger beraubt; dieses wechselt weitgehend zum elektronegativeren Element. |
|
 |
Im Extremfall eines möglichen Gedankenexperiments läge dann eine Ionenbindung vor,
bei der der positiv geladene Partner – nämlich das nur noch aus dem sehr kleinen Kern bestehende Wasserstoffion
– zwei der riesigen negativen Ionen binden kann. |
|
 |
Wir erhalten folgende Schemazeichnung: |
| |
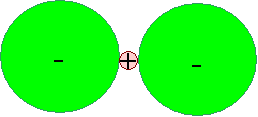 |
Ein extrem kleines H+-Ion mit zwei
angelagerten F–-Ionen |
|
| |
 |
Klar ist, daß das H+-Ion allenfalls zwei
der Riesen binden kann – für ein drittes F–
oder auch O–-Ion ist einfach kein Platz mehr. |
|
 |
Der Extremfall der totalen Ionisierung des Wasserstoffs wird zwar in der Realität nicht
vorkommen; es reicht aber auch eine nicht 100%-ige Verschiebung des Wasserstoffelektrons, um die Effekte der Wasserstoffbrückenbindung
zu erhalten. |
|
 |
Überall, wo Wasserstoff an F, O oder N hängt, gibt es damit
noch die Möglichkeit, eine relativ schwache Bindung auf der anderen Seite des H-Atoms einzugehen – es
bildet sich eine "Wasserstoffbrücke". |
|
 |
Dabei ist die Geometrie der Bindungen durch die Form der Moleküle vorgegeben. In biologischen
Substanzen sind es oft Wasserstoffbrücken, die den langen Eiweißketten ihre typische Knäuelform geben, denn
die Stellen in der Kette, an denen Wasserstoffbrücken gebildet werden können, müssen durch richtige Faltung
aufeinandertreffen. |
|
 |
Auch das gewöhnlich Eis, das jeden Winter die Umsätze der Autoreparaturwerkstätten
nach oben treibt, verdankt seine Kristallstruktur der Wasserstoffbrückenbindung. Die Moleküle des Wassers in ihrer
typischen Gestalt passen nur in ganz spezifischer Weise aneinander; sie formen einen Kristall. |
| |
|
|
Allgemeiner Bindungsfall |
| |
|
 |
Ionenbindung, kovalente Bindung und Metallbindung in der behandelten Art sind
Idealisierungen, Extremformen der realen Bindungen. Es gibt zwar viele Moleküle
und Festkörper, in denen diese Bindungen weitgehend in Reinkultur vorliegen, im allgemeinen Fall jedoch sind Bindungen
gemischt . Beispiele dafür: |
 |
Mischung von Metallbindung und kovalenter Bindung. |
|
 |
Bei Metallen kann trotz vorherrschender Metallbindung noch eine kovalente Komponente vorliegen, damit kommen
bei der Anordnung der Atome zu einem Festkörper gerichtete Kräfte ins Spiel – z.B. beim Eisen (Fe);
das hat Konsequenzen für die resultierende Kristallstruktur: Sie ist nicht mehr unbedingt dichtest gepackt! |
 |
Mischung von Metall- und Ionenbindung . |
|
 |
Bei Metallen, die aus zwei Atomsorten bestehen (man nennt das Legierungen
oder intermetallische Verbindungen), treten in der Regel ionische Bindungskomponenten
auf, insbesondere wenn sich die Metalle in ihrer Elektronegativität stark unterscheiden. Denn dann wird ein gewisser
Elektronentransfer zum elektronegativeren Element erfolgen; die Atome unterscheiden sich dann in ihrem Ladungszustand. |
|
 |
So haben beispielswiese Al-Li-Legierungen eine starke ionische Komponente, wohingegen Al-V-Legierungen
nur metallische Bindungen aufweisen. |
 |
Mischung von kovalenter und ionischer Bindung. |
|
 |
Nichtmetalle (z. B. Oxide wie SiO2) oder Halbleiter und Halbmetalle (wie GaAs
oder SnO2) besitzen kovalente und ionische Anteile. |
|
 |
Im Quarz (SiO2), einem extrem wichtigen Material der ET&IT,
sind die ionischen und kovalenten Bindungsanteile etwa gleich stark. Die Konsequenz ist, daß die Richtungsabhängigkeit
der kovalenten Bindung im SiO2 die Kristallstruktur bestimmt. |
 |
Hier die Fragen: |
| |
|
© H. Föll (MaWi für ET&IT - Script)


