|
Man kann vier Bindungstypen unterscheiden:
- Ionische Bindung
- Kovalente Bindung
- Metallbindung
- Sekundärbindungen
|
|
|
|
 |
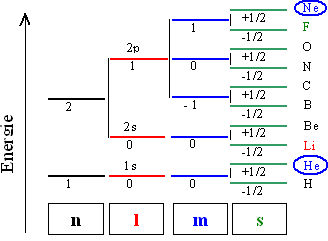
Treibende Kraft für alle Bindungen ist die Möglichkeit der Energieabsenkung
durch Annäherung an "abgeschlossene" Schalen oder Orbitale (Edelgaskonfiguration) plus evtl. daraus folgende
Coulombanziehung. | |
|
 |
Die "Entfernung" von der Edelgaskonfiguration bestimmt, was "passiert". |
|
|
| |
| |
 |
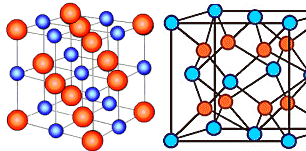
Die anziehenden Kräfte der Ionenbindung
sind rein elektrostatisch. Das zugehörige Potential ist das Coulomb Potential (mit Madelungkonstante). |
|
|
|
 |
Ionenkristalle haben typischerweise starke Bindungen, sind Nichtleiter
und durchsichtig, da keine freien Elektronen vorhanden sind. |
|
|
| |
|
 |
Merke:
- Elektrische Leitfähigkeit beruht auf freien, d. h. im Kristall beweglichen
Elektronen.
- Photonen ("Lichtteilchen") interagieren nur mit freien Elektronen.
|
|
| |
| |
|
 |
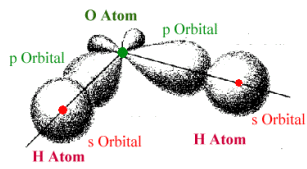
In kovalenten Bindungen
"teilen" sich die Bindungspartner einen Mangel an Elektronen. |
|
|
|
 |
Sind die Elektronen in anderen als s-Orbitalen, sind die Bindungen automatisch gerichtet. |
|
|
 |
Kovalente Bindungen sind ypischerweise starke bis sehr starke Bindungen. |
|
|
 |
Es sind typischerweise keine freien Elektronen vorhanden, d.h. kovalent gebundene Materialien
sind durchsichtige Isolatoren. | |
|
 |
Aber:
Halbleiter sind meist auch kovalent gebunden. Freie Elektronen entstehen durch thermische
Energie kB T und durch Defekte. |
|
|
| |
| |
 |
In metallischen Bindungen
werden überschüssige Elektronen an den Kristall abgegeben. |
|
|
|
 |
Die positiv geladenen Ionenrümpfe sitzen wie Rosinen im Teig des Elektronengases. Die
Bindungsstärke reicht von sehr schwach (z. B. Hg, Ga) zu sehr stark (z. B. W, Ta).
| |
|
 |
Metalle haben also eine Dichte an freien Elektronen in
der Größenordnung der Atomdichte. | |
|
 |
Metalle sind leitfähig und undurchsichtig. |
|
| |
| |
| |
 |
Sekundäre Bindungen
sind relativ schwach (und ermöglichen damit "das Leben" bei Raumtemperatur; (kBT)RT
» 1/40 eV). |
|
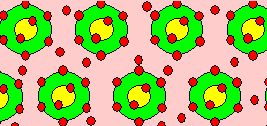
SiO2-Bindung
ionisch : kovalent » 50 : 50
gemeinsame
Elektronen sind eher beim O
Þ O ist neg. geladen |
|
|
 |
Wichtig sind Dipol-Dipol-Bindungen (Van-der-Waals-Bindungen
) und die Wasserstoffbrückenbindung. | |
 |
Im allgemeinen Fall treten Bindungen gemischt auf, z. B. SiO2: ionisch
: kovalent » 50 : 50 | |
| |
| |
|
 |
Aufgaben: | |
|
|
| |
| |
| |
| | |
| | |
| |
 |
Hier noch ein "Multiple Choice"-Test, der etwas über den Stoff
hinausgeht – man kann's ja aber mal probieren! | |
|
| |
| |
| |
| |
| | |
| | |
| |
© H. Föll (MaWi für ET&IT - Script)