|
Es ist nützlich, sich vor Aneignung dieses Kapitels noch einmal die Grundsätze
der Quantentheorie ins Gedächtnis zu rufen. Das wird zwar in dieser Einleitung auch gemacht, aber ausführlicher
findet sich das ganze in einem "Basic" Modul. |
| |
 |
Wir betrachten zunächst als Wiederholung (vergleiche MatWiss
I) das Verhalten von Elektronen bei einzelnen Atomen. Es zeigte sich, daß die Elektronen wegen des Pauli-Prinzips auf verschiedene Orbitale mit verschiedenen Energien verteilt sind.
|
|
 |
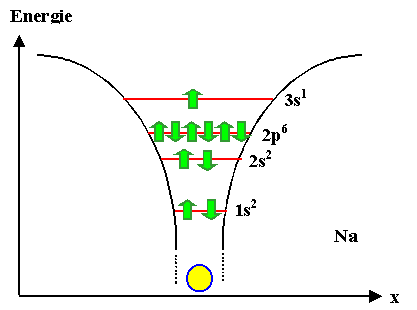
Das Bild unten zeigt die Potentialtopfdarstellung
eines Na-Atoms. Wer Probleme hat, dieses Bild zu interpretieren, sollte dringend die entsprechende Module von MaWi 1 nacharbeiten! |
|
|
 |
Bei der Annäherung von zwei Atomen (z.B. H-Atome des H2-Moleküls)
gibt es eine Aufspaltung der Atom-Energieniveaus in jeweils zwei Einzelniveaus. |
|
 |
Das muß ganz allgemein so sein, denn Atomverbünde - ob zweiatomige Moleküle,
große Moleküle oder Kristalle - haben immer nur Orbitale, oder besser Zustände
für Elektronen, die alle zur Lösung einer Schrödingergleichung
gehören. Falls die Atomzustände nicht aufspalten würden, gäbe es sehr schnell keinen Platz mehr für
die Elektronen, die im Atom einen bestimmten Zustand bevölkern, denn nach dem Pauli-Prinzip können sie nicht alle
im selben Zustand sein. |
|
 |
Das ist sofort evident für einen Festkörper: In einem Festkörper haben sich
N (mit N
» 1022) Atome soweit angenähert, daß sich jedes Energieniveau
des Einzelatoms, das im Prinzip allen Elektronen des gesamten Kristalls "zugänglich" ist, in N
Sub-Niveaus aufspalten muß. Dies gilt also insbesondere für die Energie-Orbitale
der äußeren Elektronen, weil sich deren Wellenfunktionen stark überlappen.
|
|
 |
In dieser qualitativen Betrachtung scheint ein Stück Willkür zu stecken - tut es
auch. Aber jede Willkür verschwindet sofort, wenn man die Schrödingergleichung wirklich löst (die "Willkür"
steckt dann in den verwendeten Näherungen). |
|
 |
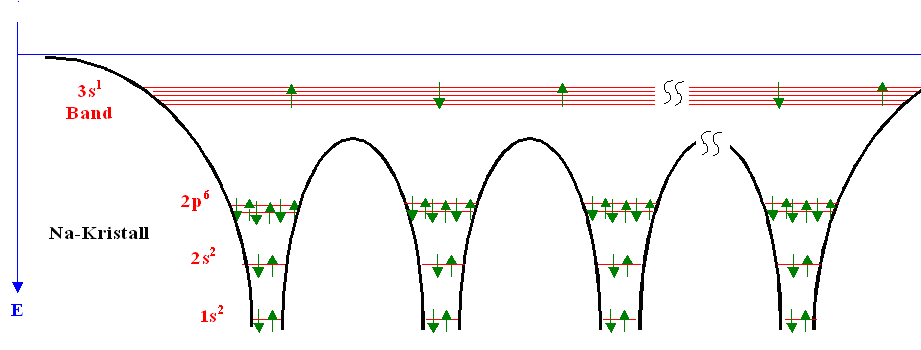
Das Prinzip der Bildung von Energiebändern
aus bestimmten Atomorbitalen (bei Na-Beispiel aus dem 3s-Orbital) ist aber im graphischen Potentialtopfmodell
problemlos nachzuvollziehen; es ist unten abermals
gezeigt. |
|
|
|
 |
Die Energie-Subniveaus liegen energetisch sehr dicht und werden auch als Energieband
bezeichnet. |
|
 |
Es gibt in dem 3s1 Band genau doppelt soviel Plätze wie Elektronen,
da jedes Atom ein Energie(sub)niveau mit zwei Plätzen beisteuert. |
|
 |
Die Aufspaltung der 2p6, 2s2 und 1s2
Niveaus ist so gering, dass wir in diesem Bild keine Bänder einzeichnen, sondern einfach die Atomniveaus beibehalten.
Letztlich sind bei jeder Bindung ja auch nur die äußeren Elektronen betroffen. |
 |
Energiebänder in Festkörpern haben einige allgemeine Eigenschaften,
die wir kurz aufzählen wollen, bevor wir sie im Detail herleiten und interpretieren: |
|
 |
Die Energieniveaus des Festkörpers liegen energetisch
niedriger als bei den isolierten Atomen. Das muß einfach so sein, denn sonst gäbe
es keinen Grund, daß die Atome "zusammenhalten". Die durch die Bildung des Festkörpers gewonnene Energie
stimmt im wesentlichen mit der Bindungsenergie (pro Atom ca. 1eV) überein.
|
|
 |
Nicht alle Energiezustände in den Bändern müssen mit Elektronen besetzt sein.
So ist z.B. beim Na das 2p-Band voll besetzt, das 3s-Band aber nur halb mit Elektronen gefüllt;
die höheren Bänder sind vollständig leer - siehe unten. |
|
 |
Bei einigen Materialien (Isolatoren, Halbleiter) stellt man im Bänderschema innerhalb
eines gegebenen Bands Energielücken (engl: "gap") fest, d.h. Energiebereiche,
in denen keine Energiezustände für Elektronen existieren. |
|
 |
Die Besetzung der Energiezustände mit Elektronen ist bei endlicher Temperatur nicht für
alle Zustände gleich wahrscheinlich. Die Besetzungswahrscheinlichkeit der Niveaus mit Elektronen regelt nicht
mehr die Boltzmannverteilung,
die nur für "klassische" Teilchen gilt, sondern die Fermi-Dirac
Statistik; die wir uns noch erarbeiten müssen. |
 |
Die Thematik der kommenden Kapitel ist damit vorgegeben. Insbesondere
interessieren wir uns für folgende Themen: |
|
 |
Wie genau kommen die Bänder zustanden? Wie entstehen Energielücken? |
|
 |
Wie groß sind die beteiligten Energien? Welche Faktoren bestimmen die Zahlenwerte? |
|
 |
Wie genau sind die einzelnen Zustände in einem Band verteilt? Wie groß ist die
"Zustandsdichte", d.h. die Zahl der individuellen Niveaus in einem Band in
einem gegeben Energieintervall bei der Energie E? |
|
 |
Welche Niveaus werden von den vorhanden Elektronen auch bevölkert oder anders gefragt,
wie groß ist die Besetzungswahrscheinlichkeit für einen bestimmten Platz? Was genau bedeutet die bereits angesprochene
Fermi-Dirac Statistik? |
 |
Diese Fragen lassen sich leicht veranschaulichen. Wir betrachten dazu den Übergang
vom Studierendengas, in dem N Studierende (aus Sicht des Professors alle
ununterscheidbar) in der Lobby wild und völlig ungeordnet durcheinanderlaufen, zum Studierendenfestkörper. |
|
 |
Der Studierendenfestkörper ist durch den Hörsaal
vorgegeben, der definierte Energieniveaus hat (= Höhe der Sitzreihe in einem gestuften Hörsaal) mit einer
bestimmten (und im allgemeinen verschiedenen) Zahl von Plätzen pro Energieniveau (= Zahl der Sitzplätze in einer
Reihe). Das sind die durch die Art des Kristall vorgebenen Energiewerte (= Stufung) plus der Zustandsdichte (= Zahl der Plätze pro Stufe).
|
| |
|
|
 |
Es gibt eine definierte Zahl von Plätzen bei definierten; d.h. mit einem Index n
numerierbaren (potentiellen) Energien En. Viele, aber nicht alle Plätze sind mit Studierenden
besetzt. Welcher Verteilungsfunktion die Studis folgen d.h. mit welcher Wahrscheinlichkeit
Plätze bei der Energie En besetzt werden, ist aber nicht so klar. Wir können nicht unbedingt
davon ausgehen, daß die Studis die (freie) Energie minimieren, denn dann müßten sie die vorhandenen Plätze
von "unten" kommend lückenlos auffüllen und die "oberen" Plätze freilassen |
|
 |
Bei der derzeitigen Entwicklung der Architektur ist es nur eine Frage der Zeit, bis die Parameter
Energieniveaus En und Zahl der Plätze bei En als Funktion einer Koordinate
ziemlich beliebig werden (im Gegensatz zu dem altmodischen Hörsaal, in dem die Abstände der Stufen i.d.R. konstant
sind (d.h. En+1 – En = const, und pro Stufe gleichviel (oder stetig ansteigende)
Platzzahlen vorliegen). Im allgemeinen wird es aber immer diskrete Energiewerte geben, mit einer beliebigen, aber gegebenen
Zahl von Plätzen pro Energiewert. |
|
 |
Die Verteilung der Studierenden auf die vorhandenen Plätze entspricht dann der Verteilung
der Elektronen in einem Band. Und genausowenig wie Studis die vorhandenen Plätze von unten an vollständig auffüllen,
tun das die Elektronen - das wäre zu ordentlich. Wir ahnen damit schon, daß die Entropie
wieder eine wichtig Rolle spielen wird. |
|
|
|
© H. Föll (MaWi 2 Skript)