|
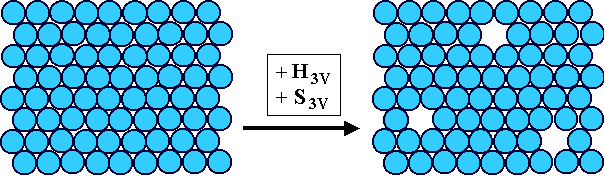
Links ein perfekter Kristall, rechts ein Kristall mit 3 Leerstellen. Im
Vergleich zu dem perfekten Kristall enthält er sowohl mehr Enthalpie als auch mehr Entropie. |
|
 |
Da wir den Vergeich bei beliebigen Temperaturen machen, kann auch unser "perfekter"
Kristall Entropie = Unordnung enthalten: Die Atome sitzen dann nicht still, sondern vibrieren mit statistisch wechselnder
Frequenz und Amplitude, d.h. unordentlich, um ihre Gleichgewichtsposition. Wir ignorieren
aber diesen Beitrag und betrachten nur die Entropie Sn die von n Leerstellen erzeugt
wird. |
 |
Die freie Enthalpie des perfekten
Kristalls ist also ganz allgemein |
|
|
|
 |
Die freie Enthalpie des Kristalls mit drei
Leerstellen nennen wir G3V. |
|
 |
Wir erhalten G3V aus der freien Enthalpie des perfekten Kristalls
indem wir die zusätzliche Enthalpie H3V, die in den Leerstellen
steckt zu H0 addieren und die zusätzliche Entropie S3V
die durch die jetzt größerer Unordung entsteht zu S0. Wir erhalten |
| |
| G3V = (H0 + H3V) –
T · (S0 + S3V) |
|
|
|
 |
Es ist jetzt gut möglich, daß für eine bestimmte Zahl an Leerstellen die freie
Enthalpie kleiner ist als für den perfekten Kristall, da der Zuwachs an T · S, Entropie mal Temperatur,
den Zuwachs an Enthalpie überwiegen kann. |
 |
Wie groß sind die Enthalpie- und Entropiebeiträge der Leerstellen?
Zunächst zu der zusätzlichen Enthalpie, die benötigt wird um eine Leerstelle zu erzeugen. |
|
 |
Formal muß man, um ein Atom zu entfernen, alle Bindungen
des Atoms lösen. Dazu muß eine Energie, oder besser Enthalpie,
aufgebracht werden, die ungefähr der gesamten Bindungsenergie entspricht. Die ungesättigten Bindungen der Nachbaratome
der Leerstelle werden sich evtl. etwas umkonfgurieren, dabei wird dann wieder etwas Energie gewonnen. |
|
 |
Insgesamt muß immer eine definierte Energiemenge, die Bildungsenthalpie
HF(V) einer Leerstelle, aufgebracht werden (der Index "F" steht für "formation"). |
|
 |
Theoretisch ist HF(V) nur mit größter Mühe, und auch
dann nur in nicht besonders guter Näherung errechenbar. Die Bildungsenthalpie einer Leerstelle in einem gegebenen Kristall
ist aber trotzdem eine wohldefinierte Größe und im Zweifelsfall experimentell
bestimmbar; wir setzen sie einfach als gegeben voraus. |
|
 |
Man kann die Bildungsenthalpie auch mit dem (negativen) Energiegewinn
identifizieren, der anfällt wenn wir die Leerstelle (gedanklich) wieder mit dem passenden Atom auffüllen. |
 |
Damit können wir den Vergleich perfekter Kristall - Kristall mit n
Leerstellen weiter quantifizieren, da wir zur Erzeugung von n Leerstellen die zusätzliche Enthalpie n
· HF(V)
brauchen. Hier der unmittelbare Vergleich |
|
|
| Perfekter Kristall |
Kristall mit n Leerstellen |
| 0 Leerstellen |
n Leerstellen |
| Es gibt nur eine Anordnungsmöglichkeit
der 0 Leerstellen bzw. der N Atome |
Es gibt viele Anordnungsmöglichkeiten der n
Leerstellen. | | S0 = 0 |
Sn = S(n) ³ 0 |
Damit ist
G0 = H0 – T · 0
= H0 |
Gn enthält die zusätzlichenEnthalpie um n
Leerstellen zu bilden und die zusätzliche Entropie:
Gn = H0 + n · HF(V) – T · S(n) |
Das Minimum der freien Enthalpie wird bei einer
bestimmten Zahl von Leerstellen erreicht sein, diese Gleichgewichtszahl bestimmt sich aus
dG(n)
dn |
= HF(V) – T · |
dS(n)
dn | = 0 |
|
|
 |
Wir müssen nun nur noch S(n) berechnen. Mit der Entropieformel
S = k · ln (pi/Spi) von Boltzmann ist
das leicht (haha) möglich. |
 |
Die Frage ist zunächst, wieviel Mikrozustände
pi es zum Makrozustand "i = n Leerstellen
verteilt auf N Plätze" gibt, wobei Leerstellen - im Gegensatz
zu Würfeln - ununterscheidbar sind. Außerdem kann natürlich nur
immer eine Leerstelle auf einem Platz sitzen. Die Zahl der Mikrozustände ergibt dann das pi
für die Formel. |
|
 |
Das ist eine Standardaufgabe aus der elementaren
Kombinatorik. Die Formel dazu ist leicht herleitbar; wir betrachten dazu eine Tabelle der Möglichkeiten beginnend
bei n = 0. |
| |
| n (= i) |
pn = |
Kommentar |
| 0 | 1 |
Es gibt genau eine Möglichkeit keine
Leerstelle zu haben: Alle Atome auf ihren Plätzen. |
| 1 | N |
Es gibt N Plätze für die 1. Leerstelle und damit N
Mikrozustände | | 2 |
|
Es gibt N Plätze für die 1. Leerstelle und noch N
– 1 Plätze für die 2. Leerstelle.
Auch wenn wir die Leerstellen unterscheiden könnten,
bringt vertauschen jedoch nichts neues - die Anordnugen sind ununterscheidbar. Wir müssen also noch durch 2 dividieren |
| 3 |
N · (N – 1) · (N – 2)
2 · 3 |
|
Vertauschen aller 3 Leerstellen bringt nichts neues da die möglichen Anordnungen
auch ununterscheidbar sind, wir müssen deshalb durch 6 = 2 · 3 dividieren |
| ... | ... |
usw. | | n |
N · (N – 1) · (N – 2) · .... ·
(N – (n– 1))
1 · 2 · 3 · ... · n |
|
Wir haben ein offenkundiges Bildungsgesetz.
Der Nenner ist per definitionem n!
gesprochen "Enn Fakultät" | | n |
N · (N – 1) · (N – 2) ·
.... · (N – (n – 1))
n! |
· |
(N – n)!
(N – n)! |
| Kleiner Trick:
Wir erweitern mit (N – n)! und erhalten |
| n |
N!
n! · (N – n)! | = |
æ
è |
N
n |
ö
ø |
|
Das ist eine so häufige Formel, dass sie einen eigenen Namen und Symbol hat:
æ
è |
N
n |
ö
ø |
= Binomialkoeffizient |
|
|
 |
Zur Berechnung von S(n) bräuchten wir noch p0
= S pi. |
|
 |
In aller Regel, wie schon ausgeführt,
kann man sich aber die explizite Berechnung ersparen, wir werden gleich sehen warum. Die Entropieformel lautet jetzt |
| |
| Sn = k · ln |
pn
p0 |
= |
k · ln pn – k · ln p0 |
|
|
|
 |
Der zweite Term ist eine Konstante; wir können sie mit S ' bezeichnen.
Die Entropieformel heißt dann Sn = k · ln pn – S
', oder mit der Formel für pn |
| |
| Sn = k · ln |
æ
è |
N!
n! · (N – n)! |
ö
ø |
– S ' | = |
k · | æ
è |
ln N! – ln n! – ln (N - n)! |
ö
ø |
– S ' |
|
|
 |
Damit ist die Errechnung der Gleichgewichtszahl an Leerstellen über dG(n)/dn
= 0 jetzt eine mathematische Aufgabe geworden. |
|
 |
Im wesentlichen ist dS(n)/dn zu bilden, also |
| |
dSn
dn |
= k · |
d
dn |
æ
è
|
ln N! – [ln n! + ln (N – n)!] |
ö
ø |
– S ' |
|
|
|
 |
Wir sehen sofort, daß der Term S' herausfällt, wir
müssen ihn zur Berechnung von Gleichgewichten also gar nicht kennen - und das gilt
ganz generell, wie schon gleich zu Beginn bemerkt! |
 |
Die mathematische Aufgabe reduziert sich auf die Berechnung von
|
| |
d [lnn!]
dn |
+ |
d [ln(N – n)!]
dn |
= | 0 |
|
|
 |
Da man Funktionen mit Fakultäten nicht so recht differenzieren
kann (sie sind ja gar nicht stetig) ist es jetzt notwendig, einige Näherungen
zu machen: |
 |
Mathematische Näherung: Anwendung der
einfachsten Version der Stirlingschen
Formel für Fakultäten
|
| |
|
|
 |
Diese simple Formel generiert nicht nur einen ganz gut passenden Zahlenwert für nicht
zu kleine x, z.B. x = 17, sondern produziert auch eine stetige
Funktion, d.h. sie liefert auch Werte für z.B. x = 17, 31. Was 17, 31! bedeuten mag lassen wir
mal offen - aber auf jeden Fall können wir mit dieser Näherung jetzt differenzieren. |
 |
Physikalische Näherung: |
| |
|
|
 |
Das ist gerechtfertigt, da die Zahl der Leerstellen immer viel kleiner sein wird als die Zahl
der Atome. |
 |
Weiterhin benutzen wir eine einfache Definition: |
| |
|
|
 |
Konzentrationen wie oben definiert haben keine Maßeinheit;
die Konzentration 0,01 entspricht 1 % Leerstellen bezogen auf die Zahl der Atome.
Statt Prozent benutzt man aber gerne folgende Abkürzungen: |
| | |
|
 |
(Daß die amerikanische Billion der deutschen Milliarde (= 109)
und nicht der deutschen Billion (= 1012)
entspricht ist ein Quell ständiger Irrtümer in allen
deutschen Zeitungen. |
|
 |
Gebräuchlich ist auch noch |
|
|
- ppt = parts per trillion
= 10– 12 (nicht mit "parts per thousand" zu verwechseln; das gibt es nicht als Abkürzung!!!).
- ppqt = parts
per quatrillion = 10– 15
|
|
 |
Kleinere Konzentrationen sind i.a. nicht meßbar; deshalb gibt es keine gebräuchlichen
Abkürzungen nach ppqt - wohl aber für Vorsilben! |
|
 |
Man kann Konzentrationen natürlich auch auf ein bestimmtes Volumen beziehen (dann ist
die Einheit cm– 3), auf 1 mol einer Substanz oder auf Partialdrücke.
Man muß höllisch aufpassen, daß man hier keine
Fehler macht - im Link gibt es dazu viele Details. |
 |
Die nun recht einfache Mathematik überlassen wir einer Übungsaufgabe. |
| |
| Übung
5.3-2 |
Berechnung der Gleichgewichtskonzentration an Leerstellen |
|
|
|
 |
Als Ergebnis erhalten wir für die Leerstellenkonzentration im thermodynamischen Gleichgewicht |
| |
|
|
 |
Das ist die in einem vorhergehenden
Kapitel bereits postulierte Formel. Aber jetzt haben wir sie aus "first principles"
hergeleitet! |
 |
Dies bedeutet, daß für thermodynamisches Gleichgewicht
eine ganz bestimmte Konzentration cV(T) an Leerstellen benötigt
wird. |
|
 |
Kristalle ganz ohne Leerstellen bei endlicher Temperatur
oder mit der falschen Anzahl, sind nicht im chemischen
GG! Über chemisches GG reden wir deshalb, weil wir GG bezüglich einer Teilchenzahländerung ausgerechnet haben. Die "Teilchen" in diesem Fall waren
Leerstellen. |
|
 |
Der jeweilige Wert der Gleichgewichtskonzentration sinkt exponentiell
(Minuszeichen im Exponenten beachten!) mit der Bildungsenthalpie und steigt exponentiell
mit der Temperatur. Wer Probleme mit der Visualisierung von Exponentialfunktionen
hat, betätigt den Link |
 |
Wir können diese ausführliche Betrachtung jetzt sofort
verallgemeinern, denn sie gilt analog auch für andere atomare Fehlstellen: |
|
 |
Nehmen wir die Bildungsenthalpie
der Eigenzwischengitteratome HF(i)
, haben wir die Gleichung für die Gleichgewichtskonzentration an Eigenzwischengitteratomen. |
|
 |
Nehmen wir eine spezifische Enthalpie zur Beschreibung des Einbaus eines Fremdatoms, HL(FA),
beschreiben wir die Löslichkeit eines Fremdatoms, d. h. die optimale
Konzentration bei einer bestimmten Temperatur. HL(FA) beschreibt dabei die Energie die am aufbringen
muß, um ein Fremdatom ins Gitter einzubauen. |
|
 |
Hier muß man allerdings ein bißchen aufpassen.
Während man zur Erzeugung, d.h. zum Einbau einer Lehrstelle oder eines ZGA
immer Energie aufwenden muß, kann HL(FA)
auch mal negativ sein, d.h. man gewinnt Energie
durch Einbau eines Fremdatoms (Kristallatome haben lieber ein Fremdatom als Nachbar, als eines der eigenen Sorte). Auch
kann HL(FA) sehr klein sein (d.h. es ist dem Kristall dann ziemlich egal, wer auf den Gitterplätzen
sitzt). |
 |
Solange die Konzentrationen klein sind, d.h. die diversen atomaren Fehlstellenarten
sich gegenseitig "nicht sehen", sind alle Konzentrationen einfach additiv - GG verlangt nach der jeweils
richtigen Konzentration aller im System machbaren atomaren Fehlstellen. |
 |
In jedem Fall erfordert das Minimum der freien Enthalpie, daß eine bestimmte
Konzentration an atomaren Fehlstellen vorhanden sein muß. Für hohe Bildungs-
oder Löslichkeitsenthalpien oder niedrige Temperaturen kann diese Konzentration beliebig klein werden, mathematisch
Null wird sie jedoch nie! |
|
 |
Physikalisch Null ist eine Konzentration aber spätestens
dann, wenn weniger als ein atomarer Defekt auf alle Atome des betrachteten Kristalls
kommen. Dies ist bei makroskopischen (mit dem bloßen Auge sichtbaren) Kristallen rund und roh bei Konzentrationen
von c » 10– 21 der Fall. |
|
 |
Meßtechnisch sind allerdings schon Konzentrationen von c
£ 10– 10 meist nicht mehr direkt erfaßbar. Das schließt
aber nicht aus, daß atomare Defekte in derart kleinen Konzentrationen trotzdem
noch die Eigenschaften eines Materials beeinflussen können. |
|
| |
|
Entstehung
und
Vernichtung von intrinsischen atomaren Fehlstellen |
| |
|
 |
Die Thermodynamik schreibt einem Kristall zwingend vor, wieviele Leerstellen und
Eigenzwischengitteratome er im thermodynamischen Gleichgewicht und einer gegebenen Temperatur haben muß. Bei einem
Wechsel der Temperatur ändert sich die Gleichgewichtskonzentration, und das bedeutet, dass atomare Fehlstellen entweder
erzeugt oder vernichtet oder werden müssen - je nachdem ob wir die Temperatur erhöhen bzw, erniedrigen |
|
 |
Wie kann ein Kristall in der Realität AF's erzeugen oder vernichten? Ein Atom
kann ja nicht einfach so verschwinden (und an der Oberfläche wieder auftauchen) wie wir das mit der Mathematik postulieren. |
|
 |
Umgekehrt, wie kann eine vorhandene Leerstelle verschwinden? Indem sie mit einem Eigen-ZGA
rekombiniert, OK; aber da es in der Regel
sehr viel weniger ZGA's als Leerstellen gibt, wird das nicht viel nützen. |
 |
Die Antwort ist einfach im Prinzip und komplex in der Praxis: |
|
 |
Erzeugung und Vernichtung von AF's geschieht mit Hilfe anderer Defekte; insbesondere Versetzungen
und Korngrenzen. Beide Defektsorten können AF's emittieren oder absorbieren. |
|
 |
In Kapitel 10 werden wir lernen wie das geht
(und was dabei mit den Korngrenzen und Versetzungen geschieht). Die Links führen auf Unterkapitel mit relevanten Bildern,
die aber auch schon in dem hier diskutierten Zusammenhang sofort verständlich sind: |
|
 |
Darüberhinaus können AF's formal verschwinden, indem sie sich zu größeren Defekten,
z.B. "Voids" oder Versetzungsringen zusammenlagern - das hatten wir schon früher
angesprochen. |
 |
.Wenn man ein bißchen weiterdenkt, wird jedoch sofort klar, dass für
alle diese Prozesse Zeit benötigt wird, da die AF's erstmal die "Partner finden (oder verlassen) müssen.
Dazu müssen sie diffundieren. |
|
 |
Die Einstellung eines neuen Gleichgewichts wird also schnell erfolgen können, falls die AF's
sehr beweglich sind. Falls sie aber nur langsam und träge im Gitter herumdiffundieren, kann es auch sehr lange dauern
- Stunden, ein Menschenalter, ein Millenium, ein Alter des Universums. |
 |
Was wir hier betrachten ist der Weg ins Gleichgewicht
- die Kinetik. Sie wird uns ein eigenes Kapiutel wert sein! |
|
|
|
Einige Zahlen |
| |
|
 |
Wie groß sind reale Bildungsenergien
und Konzentrationen? |
|
 |
Zunächst gilt (fast) immer |
|
|
|
|
 |
d.h. die Konzentration an Leerstellen wird i.d.R. viel größer sein als die Konzentration
an Eigenzwischengitteratomen. Die große Ausnahme hier, wie auch bei vielen anderen Eigenschaften, ist Silizium. Im Link
sind einige der bemerkenswerten speziellen Eigenschaften von Si zusammengefaßt. |
|  |
Typische Werte für die Bildungsenthalpien der Leerstellen sind: |
| |
| Kristall |
HF(V) [eV] |
| Ag | 1,1 |
| Al | 0,76 |
| Au | 0,98 |
| Cu | 1,0 |
|
|
| Si |
? 2,0 - 4,5
nicht eindeutig geklärt |
|
 |
Damit erhält man als groben Richtwert für die maximale Leerstellenkonzentration
am Schmelzpunkt der gebräuchlichen Metalle, cV(max) »» 10– 4 |
|
 |
Bei Si, anderen Halbleitern und kovalent gebundenen Kristallen ist die maximale Konzentration aber
viel kleiner und nicht direkt meßbar - und trotzdem von überragender Wichtigkeit,
wie wir noch sehen werden. |
 |
In nächsten Unterkapitel wollen wir uns noch etwas detaillierter mit der Konzentration
atomarer Fehlstellen beschäftigen, wie sie durch die hier abgeleitete Formel beschrieben wird. |
| | |
| |
|
| | |
© H. Föll (MaWi 1 Skript)