 |
Berechnen wir mal klassisch das Sonnensystem, aber mit allen
Planeten und Monden und den jeweiligen Wechselwirkungen. |
|
 |
Das Ziel besteht darin, die Positionen ri(t)
der Schwerpunkte aller N Teilnehmer i (Sonne, Planeten, Monde, ...) als Funktion der Zeit auszurechnen.
Alternativ reicht auch der Impuls pi(t). Die Energie – konstant für das
gesamte System – ergibt sich dann daraus. |
|
 |
Wir benutzen hier die Newtonsche Grundgleichung in folgender Form, in der links die Wirkung
(Beschleunigung) und rechts die Ursache (Kraft) steht: |
|
|
|
|
 |
In anderen Worten: Die momentane Beschleunigung des Körpers i (und daraus seine
Bahn) ergibt sich als der Kehrwert der Masse mi mal der momentanen Kraft Fi.
Bei einem gegebenen Potential kommt diese Kraft durch Addition der negativen Ableitungen (nach den Koordinaten von Körper
j) der Potentiale zwischen Körper i und allen anderen j im Abstand rij(t) zustande:
|
| |
Fi(t) = – S
j¹i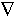 j U (rij(t)) j U (rij(t)) |
|
|
|
 |
Diese Beschreibung kann bei jedem klassischen Vielteilchenproblem verwendet werden; welches
Problem konkret behandelt wird, bestimmt das Potential. Beim Sonnensystem ist U(
rij) das Gravitationspotential zwischen den Körpern i und j. Es ist mathematisch
bis auf einen Zahlenfaktor identisch mit dem (anziehenden) Coulombpotential. |
|
 |
Betrüblich ist: Niemand kann das resultierende Gleichungssystem (es sind N
gekoppelte Differentialgleichungen) für mehr als N=2 Körper analytisch lösen. Sonne + Erde
geht; Sonne + Erde + Mond, das sog. "Dreikörperproblem ", geht analytisch
nicht mehr. Numerisch ist es aber kein allzu großes Problem. |
 |
Ganz allgemein betrachtet, ist das Potential U(r)
der Input des zu lösenden Problems, und die Koordinaten r(t)
sind der Output
. Die Newtonschen Grundgesetze stellen die Verknüpfung von Input und Output her.
|
|
 |
Eine solche formale Struktur findet man immer wieder in der Physik – auch in der Quantenmechanik! |
|
 |
Jetzt berechnen wir mal quantenmechanisch
das Wasserstoffatom – ein System aus einem Elektron, das sich um ein Proton bewegt. Klassisch wäre das Problem
vollständig analog zum Erde-Sonne-Problem. Wir beginnen mit der Definition von Input,
Output und Verknüpfung. |
|
 |
Input: Potential (hier das Coulombpotential) |
| |
| U(x, y, z) = |
U(r) = – |
e2
4pe0|
r| |
|
|
|
 |
Output: Wellenfunktion
y(x,y,z) |
|
 |
Verknüpfung: Schrödingergleichung |
| |
| – |
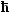 2 2
2m |
æ
ç
è |
¶2y(x,y,z)
¶x2 | + |
¶2y(x,y,z)
¶ y2 | + |
¶
2y(x,y,z)
¶z2 |
ö
÷
ø | + |
æ
è |
U( x,y,z) – E |
ö
ø |
· y
(x,y,z) = 0 |
|
|
|
 |
Dabei ist 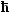 =h/(2p) und h
=Plancksches Wirkungsqantum
=6.626 ·10 –34 J·s und m die Masse des betrachten Teilchens (hier die des
Elektrons). E ist die immer extrem wichtige Gesamtenergie
des zu berechnenden Systems. =h/(2p) und h
=Plancksches Wirkungsqantum
=6.626 ·10 –34 J·s und m die Masse des betrachten Teilchens (hier die des
Elektrons). E ist die immer extrem wichtige Gesamtenergie
des zu berechnenden Systems. |
 |
Strukturell gibt es keinen prinzipiellen Unterschied zur klassischen Vorgehensweise:
Alle relevanten Informationen über das zu berechnende System stecken im Potential U(r),
und wir lösen eine Differentialgleichung, die U(r) enthält. |
|
 |
Im Vergleich zu der Differentialgleichung der Newtonschen Welt kommt die
Zeit hier überhaupt nicht vor! Merkwürdig. Das gilt aber nur für
zeitunabhängige Potentiale. |
|
 |
Generell gilt: Was immer als Lösung der obigen (zeitunabhängigen) Schrödingergleichung
herauskommt, darf mit dem Phasenfaktor
exp(i wt) multipliziert werden, falls die Zeitabhängigkeit explizit gewünscht
wird. Die Kreisfrequenz w ist über E=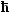 w definiert.
Dieser Phasenfaktor ist aber weitgehend bedeutungslos und wird hier immer weggelassen. w definiert.
Dieser Phasenfaktor ist aber weitgehend bedeutungslos und wird hier immer weggelassen. |
| |
 |
Für das Wasserstoffatom läßt sich die Schrödingergleichung
gerade noch analytisch lösen (mit gewissen Vereinfachungen). |
|
 |
Man erhält ¥ viele Lösungen
für die Wellenfunktion, von denen die einfacheren ungefähr so aussehen (dargestellt ist das Maximum der Wellenfunktion): |
| |
|
|
 |
Wir verzichten auf die Wiedergabe der Formeln (viel zu lang), beachten aber, dass es für
die ¥ vielen Lösungen eine klare Numerierungssystematik gibt, die am besten
durch drei Numerierungsindizes, die wir ab sofort Quantenzahlen
nennen, dargestellt werden kann: |
|
|
| einzelne Wellenfunktion: |
yn,l,m (x,y,z) |
|
n
: Hauptquantenzahl; n = 1, 2, 3, ... |
| | |
l
: Nebenquantenzahl; l = 0, 1, 2, 3, ..., n – 1
|
Dazu gehören folgende "symbolische Werte":
s (zu l=0), p (zu l=1),
d (zu l=2), ... | | |
m: magnetische Quantenzahl;
m = l , l – 1, ..., 1, 0, –1, ..., –l |
|
|
|
 |
Außerdem erhält man für jede Lösung die Gesamtenergie E
als |
| |
|
 |
Wer's nicht glaubt, schaut sich den Rechnungsgang im Link
an. |
 |
Jede der möglichen Wellenfunktion yn,l,m(x,y,z)
plus die zugehörige Gesamtenergie En beschreibt einen möglichen Zustand des Systems "Elektron im Wasserstoffatom". |
|
 |
Da die Quantenzahlen l und m in der Energieformel nicht auftauchen,
ist die Energie für alle Zustände mit gegebener Hauptquantenzahl n und allen damit möglichen
Werten von l und m identisch; weil sich diese Zustände nicht in der Gesamtenergie unterscheiden,
bezeichnet man sie als diesbezüglich entartet.
|
|
 |
Wir könnten jetzt einen Potentialtopf für das Wasserstoffatom zeichen mit ausgerechneten
Energieniveaus und einer Angabe, wieviele Elektronen auf einem dieser Niveaus Platz
haben. Ein Beispiel: Für n=2 kann l die Werte 0 und 1 annehmen, ferner gehören
dazu m=0 für l=0 sowie m=0, +1 und –1 für l=1.
Wir haben also für n=2 die Lösungsmannigfaltigkeit y 2,0,0,
y2,1,0, y
2,1,-1 und y2,1,+1; alle 4 Wellenfunktionen beschreiben
Lösungen mit derselben Gesamtenergie E2. |
|
 |
Zum Energieniveau E2 gehören also 4 Zustände, es
ist damit vierfach entartet. Damit haben 8 Elektronen Platz auf diesem Niveau: 4 mit Spin
"up" und 4 mit Spin "down"
- und was zum Teufel ist ein "Spin"? |
 |
Wir können jetzt nicht mehr länger vermeiden, den "Spin" der Elektronen (und aller anderen Elementarteilchen)
zu definieren. Wir tun das hier einfach und unpräzise (Details finden sich in obigem Link):
- Der Spin eines Elementarteilchens ist eine elementare und unveränderliche Eigenschaft - so wie seine Masse oder
seine Ladung.
- Es gibt (relativ zu einer präzisen Definition) Teilchen mit "halbzahligem"
Spin und Teilchen mit "ganzzahligem" Spin.
- Elektronen, Protonen, Neutronen , ... haben halbzahligen Spin mit genau zwei möglichen
Werten der Spinquantenzahl
s=+½ und
s=–½; solche Teilchen heißen "Fermionen" (und unterliegen
der Fermi-Dirac-Statistik).
- Mit dem Spin verknüpft ist ein magnetisches Moment; unsere Teilchen sind
kleine magnetische Dipole.
- Photonen
(="Lichtteilchen"), viele Atome und einige "Exoten" haben ganzzahligen
Spin. Solche Teilchen heißen " Bosonen" (und unterliegen der Bose-Einstein-Statistik).
|
|
 |
Das schaut viel komplizierter aus, als es eigentlich ist. Wir merken uns zunächst nur,
dass Elektronen immer in zwei Varianten kommen: Spin=+½ oder Spin=–½.
Man zeichnet das gern als kleine Pfeile (das sind dann aber keine Vektoren!) und redet
von "Spin up" oder "down", rauf oder runter, ... – egal, solange man 2 Möglichkeiten
unterscheidet. |
 |
Weil das, was oben steht, so unglaublich wichtig ist, fassen wir das jetzt schnell
in einer tabellarischen Darstellung zusammen: |
| Alle Teilchen sind entweder |
Fermionen
Spin halbzahlig
(s=±½, ±3/2, ...) |
oder |
Bosonen
Spin ganzzahlig
(s=0, ±1, ...) | | Elektron: s=±½ | |
Photon: s=1 | | Proton: s=±½ |
|
H-Atom: s=(±½) + (±½)=0 oder 1 oder –1 |
| Neutron: s=± ½ | |
Elektronenpaar ("Cooper-Paar" der Supraleitung):
s=½ – ½=0 |
| Helium-3 (2 Protonen,
1 Neutron, 2 Elektronen): |s|=½ | |
Helium-4 (2 Protonen, 2 Neutronen, 2 Elektronen):
s ganzzahlig |
| Nicht so interessant für uns: |
Omega-Teilchen: s=± 3/2,
.... |
| Mesonen: s=0
Higgs-Boson: s=0,
.... |
| Können nicht denselben Zustand besetzen |
| Können denselben Zustand besetzen |
Das Pauli-Prinzip gilt nur für Fermionen!
|
|
 |
OK – wir können jetzt im Prinzip Wellenfunktionen und Gesamtenergien
ausrechnen. Letzteres ist ja ganz nützlich. Aber was ist und wozu braucht man eine Wellenfunktion? |
| |
|
|
Wellenfunktionen |
| |
|
 |
Zunächst nehmen wir einfach mal zur Kenntnis: |
| |
- Die Wellenfunktion des berechneten Systems enthält in codierter Form alle Informationen,
die man außer der Gesamtenergie noch über das System wissen kann.
- Die Wellenfunktion ist in der Regel eine komplexe Funktion, d. h. es taucht i2
=–1 auf. 1)
- Die Wellenfunktion enthält in der Regel Terme wie exp(ik· r)
, die typisch sind für Wellen .
|
|
 |
Zu Punkt 1. Alles, was man über eine System wissen kann, sind ausschließlich
meßbare und damit reelle
Größen (wie Ort und Impuls). Eine komplexe Funktion kann man nicht messen – die enthaltene Information
muss also notwendigerweise "codiert" sein! Die Wortwahl "wissen kann" deutet an, dass es dabei Einschränkungen
gibt. In der Tat – in der Quantentheorie gilt die in der Schrödingergleichung "versteckte"
Heisenbergsche Unschärferelation: |
|
|
| Dx · D px |
³ | h | | | |
| | D E · Dt |
³ | h |
|
|
|
 |
Die Deltas geben an, mit welcher Genauigkeit oder Unschärfe man die betreffenden Parameter
kennt. Die Heisenbergsche Unschärferelation
sagt, dass bei bekannter Unschärfe Da des einen Parameters a
der jeweils komplementäre
Parameter b nicht genauer bekannt sein kann
als Db ³ h/(Da). |
|
 |
Merke: Es geht nicht darum, wie genau man messen kann, sondern welche Werte die Parameter
in einem System prinzipiell haben. |
|
 |
Zu Punkt 2: Merkwürdige Sache – so etwas kommt in der klassischen Physik
niemals vor. Falls wir für z. B. Wechselstromrechnungen die komplexe Schreibweise benutzen, heißt das ja nicht,
dass eine Spannung jetzt in komplexen Volts gemessen wird, sondern wir haben vereinbart, dass wir immer nur den Realteil
meinen. Das ist hier anders. Die Wellenfunktion ist komplex, wir meinen nicht nur den
Realteil. |
|
 |
Zu Punkt 3: ET&IT-Studis im 2. Semester können wissen, dass
eine laufende ebene Welle mit der Amplitude A0, der Kreisfrequenz
w und dem Wellenvektor
|k|=2p /l (l=Wellenlänge)
durch |
| |
|
| |
beschrieben wird. Wer's vergessen hat: Diesen Link
betätigen. |
 |
Fein. Jetzt aber zur Frage, wie man die Wellenfunktion "decodiert".
Für das "Planetensystem" aus Proton und Elektron haben wir jetzt die Energie und die Wellenfunktion für
jeden Zustand, letztere in Form merkwürdiger Gebilde, die in der reinen Mathematik
unter dem Namen "Kugelflächenfunktionen" bekannt sind. |
|
 |
Nehmen wir zum Beispiel den Doppelschnuller im Bild unten rechts
mit der Wellenfunktion ySchnu(x,y,z) und fragen uns: Wo
ist denn nun eigentlich das Elektron, falls es den zu dieser Wellenfunktion gehörenden Zustand besetzt hat? Der Index
"Schnu" steht jetzt für die entsprechende Quantenzahlenkombination (n,l,m). |
|
 |
Die Antwort gibt der klassischen "Denke" den endgültigen Todesstoß. Mit
w(x,y,z)=absolute Wahrscheinlichkeit und W=w/dV=Wahrscheinlichkeitsdichte
, das Elektron im Volumenelelement dV bei (x,y,z) zu finden, gilt: |
| |
| w(x,y,z) | = |
y(x,y,z) · y*(x,y,z) · dxdydz |
| | |
|
w(x,y,z)
dV |
= W = |
y(x,y,z) · y*(x,y,z) |
|
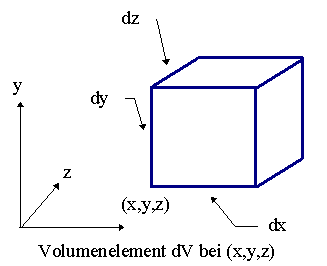 |
Das Betragsquadrat
|y(r)|2=y ( x,y,z) · y*(x,y,z)
der Wellenfunktion y(r) eines
Teilchens
an einem gegebenen Ort r =(x,y,z)
ist ein Maß für die Wahrscheinlichkeit ,
daß das betrachtete Teilchen an diesem Ort zu finden ist. |
|
|
 |
Man redet vereinfacht dann nur noch von der Aufenthaltswahrscheinlichkeit
des Elektrons. |
 |
Damit haben wir immer und überall als sehr wichtige zusätzliche Gleichung
die Normierungsbedingung |
|
|
+¥
ó
õ
– ¥ |
+¥
ó
õ
–¥ |
+¥
ó
õ
–¥
|
y(x,y,z) · y *(x,y,z) ·
dxdydz=1 |
|
|
|
 |
In Worten: Die Wahrscheinlichkeit, das Elektron irgendwo
im Universum zu finden, ist die Summe (=Integral) der lokalen Wahrscheinlichkeiten; sie ist per Definition=1 . |
 |
Fein – so neu ist das mit den Wahrscheinlichkeiten jetzt aber auch wieder
nicht, könnte man denken: Falls wir einen klassischen
Würfel werfen, können wir auch nur Wahrscheinlichkeiten berechnen. |
|
 |
Riesenunterschied! Beim klassischen Würfel berechnen wir Wahrscheinlichkeiten
nur , weil wir zu blöd sind, die Würfelbahn exakt zu berechnen. Man könnte
das aber im Prinzip tun. Mit welcher Augenzahl der Würfel seine Bahn beendet, ist
vollständig determiniert, wie alles in der klassischen Physik. Es gibt keine grundsätzlichen
Wahrscheinlichkeiten. In der Quantentheorie sind Wahrscheinlichkeiten aber grundsätzlicher Natur, und sie sind oft
das Beste, was man hat. Der Determinismus ist tot und die Zukunft ist prinzipiell offen. |
|
 |
Falls es nicht jede und jeder gemerkt hat: Ab jetzt reiten wir auf Prinzipien rum, betreiben
also Philosophie. Das kann man ergebnisoffen bis zum St. Nimmerleinstag
tun; der Link führt weiter. Aus Sicht der Wissenschaft
konstatieren wir nur: Alles, was man mit der Quantentheorie in den letzten 100 Jahren oder so gerechnet hat, war
zu 100 % richtig; in Extremfällen bis auf 7 (oder mehr) Stellen hinter dem Komma. |
 |
Bezogen auf unseren Zustand y
Schnu(x,y,z) (den wir auf Atome bezogen jetzt auch gerne mal Orbital
nennen dürfen), wissen wir jetzt, dass das Bildchen das Maximum der Wahrscheinlichkeitsdichte für das sich in
diesem Orbital befindliche Elektron illustriert. |
|
 |
Aha! Was wir angedeutet sehen, sind die Bindungsarme,
d. h. die Tatsache, dass manche Elektronen im Atom je nach Zustand sich besonders gern in einige spezifische Richtungen
hervorwagen. |
|
 |
Wir sind fertig. Mehr muss man über Quantentheorie nicht wissen, um Materialwissenschaft
auf dem Niveau des 2. Semesters treiben zu können. |
|
 |
Mit weniger geht's aber auch nicht, oder ungefähr so gut wie Wechselstromlehre ohne Sinus
und Cosinus. |
 |
Mal sehen. Nehmen wir uns jetzt mal das Helium-Atom (He) und den Rest vor. |
| |
|
|
Vom Helium-Atom bis zu Kristallen |
| |
|
 |
Das Potential für die zwei Elektronen des Systems "atomares He"
(zweifach positiv geladener Atomkern und zwei einfach negativ geladene Elektronen) sieht so aus: |
| |
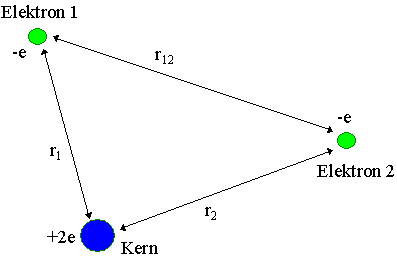 |
U(r1, r2, r12)=- 2e2/r1 - 2e2/
r2 + e2/r12
|
|
|
 |
Einsetzen in die Schrödingergleichung und fertig. Wir erhalten Wellenfunktionen
und zugehörige Energien der Art |
|
|
| y | = |
y(x
1, y1, z1, x2, y2 , z2) |
|
|
|
 |
Wie zuvor gibt das Betragsquadrat von y(
r1, r2) · y*(
r1, r2) die Wahrscheinlichkeitsdichte, das erste Elektron am Ort
r1=(x1 , y1, z1)
und gleichzeitig das zweite Elektron am Ort
r2=(x2, y2 , z2 ) zu finden. |
|
 |
Beim Würfeln mit zwei Würfeln wäre das nichts anderes als die Wahrscheinlichkeit
w(2, 5), z.B. mit einem Würfel eine 5 und mit dem anderen eine 2 zu würfeln. Das ist
übrigens etwas anderes, als die Wahrscheinlichkeit w(7), d.h. mit zwei Würfeln eine 7 zu
würfeln. Es lohnt sich, darüber mal kurz nachzudenken - wir werden das noch brauchen! |
 |
Es ist klar, was für die nächsten Atome (Li usw.) zu machen ist.
|
|
 |
Es ist nur ein Jammer, dass niemand die zugehörigen Differentialgleichungen analytisch
lösen kann. Numerisch ist das für größere Atome zwar nicht ganz so einfach, allerdings ist die Rechentechnik
inzwischen so leistungsfähig geworden, daß sog. All-electron-Rechnungen heutzutage auch bei größeren
Atomen möglich sind. |
|
 |
Wir benützen deshalb den guten alten Trick,
dass wir Kern plus z - 1 Elektronen zu einem einfach positiv geladenen "Kugelhaufen" zusammentun
und nur für das letzte Elektron die Schrödingergleichung lösen. Müssen wir aber gar nicht, denn wir
haben jetzt ja wieder im Prinzip das Wasserstoffatom. |
© H. Föll (MaWi für ET&IT - Script)