|
Es ist ziemlich schwierig und zeitraubend
eine Landkarte zusammenzustellen, aber es ist recht einfach, sie zu benutzen - nachdem
man einige Regeln und Konventionen gelernt hat. |
 |
Bei Phasendiagrammen ist es sehr ähnlich. Es ist sehr schwer, Phasendiagramme
zu berechnen, und sehr aufwendig und zeitraubend, sie zu messen. |
|
 |
Aber wenn man sie erst mal hat, können Phasendiagramme wie Landkarten benutzt
werden. Aber auch dazu muß man einige Regeln und Konventionen beachten bzw. beherrschen. |
| |
Wir werden hier aber nur die rudimentärsten Dinge behandeln!
Denn: In Phasendiagrammen
steckt sehr viel stark aggregierte Information. Um sie vollständig auswerten zu können, müßte man viele
Wochen Zeit und Arbeit investieren. Etwas weiterführende Information findet sich im Rückgrat
2 |
|
 |
Schauen wir uns an, was geschieht, wenn man in einem vollständig mischbarem
System, wie z.B. dem Ni - Cu System, eine gegebene Zusammensetzung von A
und B aufschmilzt, und dann erstarren läßt. |
|
 |
In anderen Worten: Wir gießen eine Legierung
in eine Gußform. Jedesmal, wenn ein Motorblock, eine Turbinenschaufel oder eine Zahnplombe gegossen wird, laufen solche
Erstarrungsvorgänge ab. Allerdings ist nicht gesagt, daß wir zu jedem Zeitpunkt im Gleichgewicht sind. Um mit
Sicherheit immer Gleichgewicht zu erreichen, müßten wir nämlich extrem langsam abkühlen. |
 |
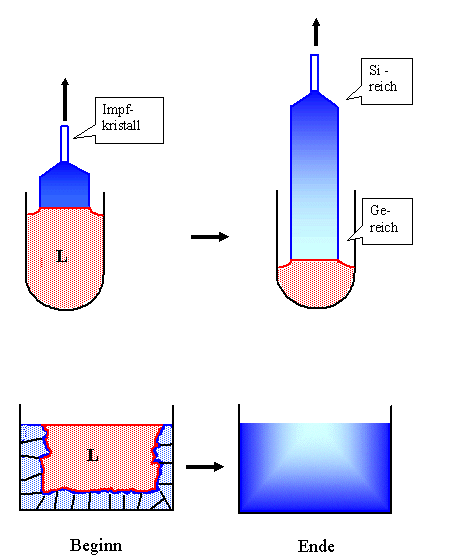
Oder wir ziehen einen Kristall aus der Schmelze, z.B. einen Si - Ge Kristall. |
|
 |
In einem Tiegel, der die flüssige Phase in der Zusammensetzung co
(z.B. x % Ge und (100 - x) % Si enthält, wird ein kleiner "Impfkristall" getaucht und dann
vorsichtig abgekühlt; gleichzeitig wird der Impfkristall langsam herausgezogen. Wenn man alles richtig macht, kristallisiert
Si -Ge am Impfkristall und man erhält einen langsam wachsenden Kristall. Das ist das Czochralski
Kristallziehverfahren; es wurde durch einen Zufall "entdeckt". |
 |
Werfen wir zum Verständnis der Vorgänge beim l a n g s a m e n
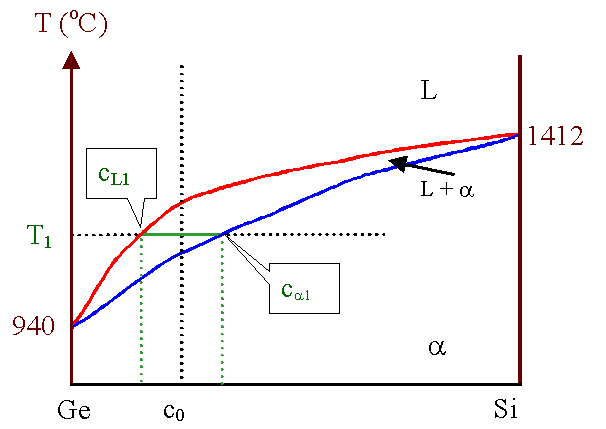
Abkühlen einen Blick auf das (halbwegs realistisch gezeichnete) Si - Ge - Phasendiagramm |
| |
|
 |
Betrachten wir die Zusammensetzung c0
und beginnen von einer (hohen) Temperatur T ausgehend, die Mischung abzukühlen. |
|
 |
Solange T ³
TL(c0) ist, d.h. gößer als die Liquidustemperatur bei der Zusammensetzung
c0, wird die Mischung komplett flüssig sein. |
|
 |
Betrachten wir nun die eingezeichnete Temperatur T1. Das Phasendiagramm
weist aus, daß bei T1 eine Mischung aus einer flüssigen Phase mit der Zusammensetzung
cL1 und einer festen Phase mit der Zusammensetzung ca1
vorliegt. |
|
 |
Die feste Phase (a - Phase) ist dabei Si - reicher
als die Ausgangszusammensetzung c0, die flüssige Phase ist Ge - reicher. Es ist aber
nur ein Teil des Systems kristallisiert. Wenn wir komplette Kristallisation haben wollen, müssen wir die Temperatur
weiter erniedrigen. |
|
 |
Tun wir das, können wir zunächst erwarten, daß der Anteil der festen Phase
größer wird, der Anteil der flüssigen Phase kleiner. Gleichzeitig wird die feste und die flüssige Phase
jetzt Ge - reicher. |
|
 |
Dies bedeutet, daß bei einer Temperaturerniedrigung relativ zu T1
jetzt zwar etwas mehr Legierung erstarrt, aber sich die Zusammensetzung des schon vorhandenen kristallisierten
Teils ändern muß: Die Ge Konzentration muß steigen. In einem Festkörper wird das
nicht so einfach sein; wir brauchen dazu die Diffusion
von Ge Atomen und zwangsläufig viel Zeit. |
|
 |
Dieser Prozeß dauert an, bis bei T £
TSol(c0) die Mischung komplett erstarrt ist mit der globalen
Zusammensetzung c0. |
 |
Es ist aber klar, daß im realen Experiment unmöglich immer Gleichgewicht
vorliegen kann. Kurz bevor wir TSol(c0) erreichen, ist das bißchen noch
vorhandene Schmelze noch stark mit Ge angereichert; beim Erstarren müßte sich das überschüssige
Ge im ganzen, bereits erstarrten Kristall gleichmäßig verteilen. |
|
 |
Wir müssen uns also klar machen, was passiert wenn wir nicht ¥
langsam abkühlen, sondern in endlichen Zeiträumen. |
|
 |
Bevor wir das aber tun, wollen wir kurz eine einfache Formel
ableiten, die uns erlaubt den jeweiligen Anteil der festen und flüssigen Phase zu berechnen. |
| |
 |
Warum die Bezeichnung "Hebelgesetz"?
Weil obige Formeln eine einfache graphische Repräsentation in Phasendiagramm haben, die an das Hebelgesetz der einfachen
Mechanik erinnert. |
|
 |
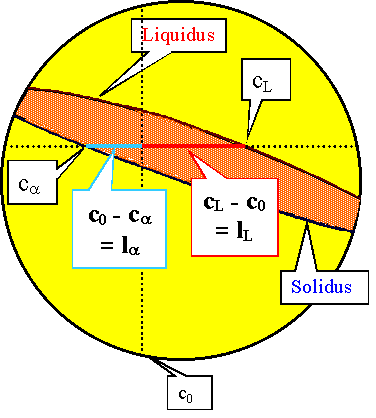
Um das zu sehen bilden wir den Quotienten fa/fL,
d.h. das direkte Verhältnis der beiden Konzentrationen: |
| |
fa
fL | = |
c0 – cL
ca – c0 |
= |
cL – c0
c0 – ca |
|
|
|
 |
c0 – cL (oder cL –
c0, je nach "Neigung" der "Linse") ist aber genau die Strecke entlang der Isotherme
von c0 bis cL, und ca
– c0 (oder c0 – ca)
ist die entsprechende Strecke bis ca - siehe folgende Graphik - wir
können diese Strecken als "Hebel" einer Länge l interpretieren. |
| |
|
 |
Damit gilt |
|
 |
Das "Gewicht" der flüssigen Phase mal dem "Hebelarm" der flüssigen Phase
muß gleich Gewicht mal Hebelarm der festen Phase sein. |
|
|
|
 |
Dazu müssen wir einige Übungen machen! |
|
|
|
| | |
|
Erstarren
im Nichtgleichgewicht |
| |
|
 |
Was für eine Zusammensetzung hat unser Gußstück oder unser Kristall,
wenn wir nicht ¥ langsam abkühlen bzw. den Kristall aus der Schmelze ziehen?
|
|
 |
Nachdem die flüssige Phase restlos verfestigt ist, ist die Zusammensetzung natürlich
(im Mittel oder global) diesselbe wie in der flüssigen Phase. Aber ist das Gußstück
oder der Kristall homogen? Ist die Zusammensetzung überall dieselbe? |
 |
Wenn wir nicht genügend Zeit geben, um den zuerst erstarrten Bereichen zu
erlauben, ihre Zusammsetzung durch Diffusion in den neuen Gleichgewichtszustand zu bringen,
werden wir einen Kristall (oder einen Gußkörper) bekommen, bei dem die zuerst erstarrten Teile (der obere Teil
des Kristalls oder die Außenseite des Gußkörpers) Si-reich sind, der untere Teil des Kristalls oder
das Innere des Gußkörpers) sind dafür Ge-reich. Fast nirgends hat der Festkörper die Zusammensetzung
c0. |
|
 |
Denn jedesmal wenn wir jetzt die Temperatur etwas erniedrigen, starten wir mit einer anderen
Zusammensetzung der Schmelze, als es dem Gleichgewichtsfall entspräche; wir bleiben nicht auf einer Isoplethe im Phasendiagramm. |
 |
Das bedeutet, daß wir gar nicht mehr die Zusammensetzung c0
in der flüssigen Phase haben. |
|
 |
Im nächsten Schritt müssen wir also untersuchen was passiert, wenn bei einer weiteren
kleinen Temperaturerniedrigung von T1 nach T2 jetzt eine Schmelze zur
Zusammensetzung cL1 kristallisiert. |
|
 |
Das Ergebnis ist klar: Beide Konzentrationen verschieben sich in Richtung Ge-reich.
Unser Endprodukt sieht schematisch so aus wie in der folgenden Graphik gezeigt. |
| |
|
 |
Die Konsequenzen dieses Verhaltens beim Erstarren sind weitreichend: |
|
 |
Auf der negativen Seite vermerken wir, daß
es offensichtlich schwierig sein kann, eine homogene Legierung mit einer festen und überall konstanten Zusammensetzung
zu gießen oder einen homogenen Kristall zu ziehen. Die Gußtechnik, nach wie
vor das Arbeitspferd der gesamten Metallindustrie, ist nicht so simpel wie man glauben könnte! |
|
 |
Auf der positiven Seite ist zu konstatieren, daß
man durch diesen Effekt Materialien auch reinigen kann. Gerade bei Si und Ge
wird eine leicht verunreinigte Schmelze oft so erstarren, daß zunächst nur eine Si- bzw. Ge - reiche
a - Phase entsteht, d.h. ein saubereres Material. Die Verunreinigungsatome bleiben zunächst
in der Schmelze. |
|
 |
Diese Technik ist unter dem Namen "Zonenreinigen"
oder "Zonenschmelzen" bekannt und hat in den frühen Jahren der Halbleiterindustrie
eine wichtige Rolle gespielt. |
 |
Damit ist aber nur eine Komplikation zum Thema
"Gießen" angesprochen. Ein weiteres Beispiel dazu, wie kompliziert das simple "Gießen" sein
kann findet sich in diesem (relativen) Link (mit Dank an
Bob Rapp und "Materials Today" für die Genehmigung der Verwendung an dieser Stelle; hier der absolute Link zum Original). |
 |
Als nächstes wollen wir nun im folgenden Unterkapitel ein etwas komplizierteres
Phasendiagramm betrachten. |
© H. Föll (MaWi 1 Skript)