|
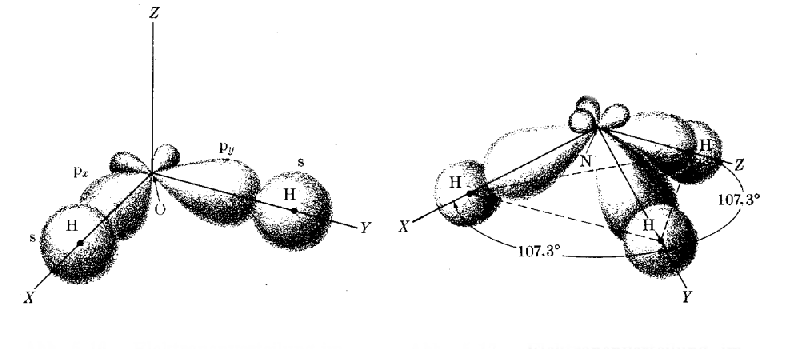
Wir betrachten zunächst das Wasser- (H2 O) und das Ammoniak-
(NH3) Molekül. Die s - Orbitale der zwei Wasserstoffatome überlappen mit einem je p-
Orbital des Sauerstoffs. Hier sind zwei Besonderheiten auffällig: |
|
 |
1. Die p-Orbitale sind verzerrt; sie sind auf der H - Atom
Seite größer als auf der O - Atom Seite. Der Grund dafür ist, daß die Anwesenheit der H
- Atome die Bewegung der p-Elektronen des O Atoms etwas ändert oder polarisiert.
|
|
 |
2. Der Winkel zwischen den Bindungsachsenist nicht 900, wie er eigentlich
bei p-Orbitalen sein sollte, sondern deutlich größer (104,50). Das liegt daran, daß
jetzt auf der Wasserstoffseite des Moleküls im Mittel mehr negative Ladungen sind,
die sich abstoßen. |
 |
Als Konsequenz fallen die Ladungsschwerpunkte nicht mehr zusammen, das Molekül
ist polarisiert und bildet einen elektrischen
Dipol. |
|
 |
Das Dipolmoment (= Ladung mal Abstand)
ist 6,2 · 10 –30 C · m; es ist verantwortlich für die hohe Dielektrizitätskonstante (er = 81) des Wassers. |
 |
Ähnlich beim Ammoniak. Statt rechter Winkel finden wir 107,30.
|
|
 |
Das Dipolmoment ist 5,0 · 10 –30 C · m. |
 |
Aussehen tut das ganze so; links Wasser, rechts Ammoniak. |
| |
|
© H. Föll (MaWi 1 Skript)