 |
Welche Bindungstypen3 sind für keine Hybridisierung,
oder für sp1, sp2 oder sp Hybridisierung möglich? |
 |
Machen wir uns zuächst eine einfache Schematik der "Bauklötzchen",
die man zusammenfügen kann. |
|
 |
Das sieht dann für keine Hybridisierung
z.B. so aus: |
| |
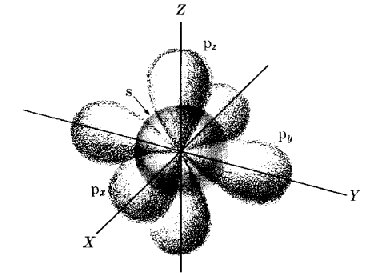 |
Die Orbitaldarstellung
von bevor |
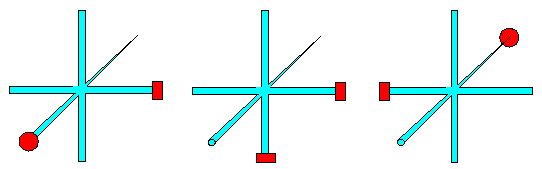 |
Schematische
Dastellung der p-Orbitale; drei Möglichkeiten für
Bindungen sind durch rote Kreise markiert.
|
|
 |
Wir können die Klötzchen jetzt an den roten Enden nach Belieben zusammenfügen,
aber: |
|
 |
Alles was man also erhalten kann sind "zick-zack" Ketten, die sich dann vieleicht
noch verknäueln; aber ein "richtiger" Kristall ist ausgeschlossen |
| | |
 |
Betrachten wir als nächstes die sp2
Hybridisierung. Dann erhalten wir 6 in einer Ebene liegenden Keulen mit 6-zähliger Rotationssymmetrie,
die alle Bindungen eingehen können. |
|
 |
Die zwei verbleibenden p-Keulen können nur eine schwache p-Bindungen in Richtung der s-Bindungsachsen eingehen. |
|
 |
Schematisch sieht das so aus: |
| |
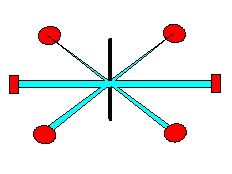 |
Schematische Dastellung der sp2-Hybridisierung.
Die möglichen Bindungen formen ein Sechseck auf einer Ebene. |
|
|
 |
Wir können einen schönen zweidimensionalen hexagonalen Kristall bilden,
so wie unten und im Link gezeigt. |
| |
|
 |
Links die Anordnung der C- oder Si-Atome auf einer Ebene, rechts
der daraus formbare Kristall, falls zwischen den Ebenen (mit starker kovalenter Bindung) wenigsten noch eine schwache Bindung
möglich ist. |
|
 |
Was wir dann bekommen ist Graphit für den Kohlenstoff; die
stabile Form als Festkörper. |
 |
sp3 Hybridisierung brauchen wir hier nicht zu behandeln, sie
ist im Haupttext ausführlich dargestellt. |
|
 |
Silizium kristallisiert ausschließlich in der mit sp3 Hybridisierung
möglichen Diamantstruktur.
Das braucht nicht weiter dargestellt werden; es genügt den Link zu betätigen. |
|
 |
Kohlenstoff kann auch das Diamantgitter annehmen - aber
nur wenn man es dazu zwingt. Es braucht extrem hohe Drücke und Temperaturen; der resultierende Diamant ist dann unter
Normalbedingungen metastabil. |
| |
|
© H. Föll (MaWi 1 Skript)


![]() Übung 3.3-5 : Hat Graphit eine hcp-Struktur?
Übung 3.3-5 : Hat Graphit eine hcp-Struktur?