 |
Die bisherigen Beispiele von Bindungstypen - ionisch, kovalent, metallisch - beschrieben
immer recht starke Bindungen. |
|
 |
Will man die entsprechenden Moleküle oder Festkörper wieder in ihre
Atome zerlegen, muß man - soweit wissen wir Bescheid - in der Regel beträchtliche Energien aufwenden. Macht man
das durch Wärmezufuhr, brauchen wir Temperaturen von mehreren hundert wenn nicht
gar tausend Grad Celsius. |
 |
Die unmittelbare menschliche Erfahrung, das Leben an sich, beruht aber auf schwachen Bindungen, die schon bei ungefähr Raumtemperatur aufgehen können.
|
|
 |
Nur dann haben wir die Möglichkeit, nützliche Stoffe aus irgendwelchen Ausgangsprodukten
zu synthetisieren ohne dabei zu verbrennen. In anderen Worten: Wir können atmen, uns bewegen, verdauen, lieben, denken:
Leben ist möglich. |
 |
Dazu gehört auch noch, daß es viele, für Lebewesen oft extrem
nützliche Substanzen gibt, die Schmelzpunkte weit unterhalb der Raumtemperatur haben und damit erst Leben ermöglichen:
O2, N2, H2O usw. |
 |
Es muß also noch Bindungstypen geben, die wir bisher nicht behandelt haben.
Wir können fragen: Welche Kräfte zwischen Atomen und Molekülen führen dazu, daß sich z. B. die
folgenden festen Substanzen bilden können? |
|
 |
Edelgas-Kristalle (gibt es für alle Edelgase außer
He bei sehr tiefen Temperaturen). Eigentlich haben die Edelgase überhaupt keinen Grund, Bindungskräfte
zu entwickeln - sie müßten auch noch bei sehr tiefen Temperaturen gasförmig sein. |
|
 |
Eis (gefrorenes Wasser). Was führt zu Kräften
zwischen den H2O - Molekülen? |
|
 |
DNS. Was hält die beiden Spiralen der Doppelhelix
zusammen - aber nur so stark, daß die Bindungen wie in einem Reißverschluß bei der Zellteilung leicht
zu öffnen sind. |
 |
Die entsprechenden Bindungsarten - es gibt mehrere davon - heißen allgemein
Sekundärbindungen weil sie in der Regel (nicht beim Edelgaskristall) zwischen
Molekülen wirken, die durch starke Primärbindungen zusammengehalten werden. .
|
|
 |
Sie sind aus biologischer Sicht alles andere als sekundär: Sie ermöglichen erst
die Biologie. |
 |
Eine der beiden wichtigsten Sekundärbindungen heißt nach ihrem "Entdecker"
van der Waals
Bindung. Die van der Waals Bindung kommt von den anziehenden Kräften zwischen
günstig orientierten elektrischen Dipolen. Zwei Fälle müssen unterschieden
werden. |
|
 |
1. Betrachten wir Moleküle, die von Haus aus Dipolcharakter haben, d.h. in denen die Ladungsschwerpunkte
der beteiligten Atome nicht aufeinander liegen - siehe das Beipiel im Link - wird es bei entsprechender Orientierung ein anziehendes Potential geben, das mit 1/r
6 abfällt. |
|
 |
2. Aber auch Atome oder Moleküle, die von Haus aus kein Dipolmoment haben - z.B. Edelgasatome
- haben nur im zeitlichen Mittel keinen Dipolcharakter. Momentan
jedoch, werden die Elektronen nicht kugelsymmtrisch verteilt sein, sondern ihr Ladungsschwerpunkt wird um die Kernposition herum fluktuieren.
|
|
 |
Und ein solcher momentaner Dipol kann ein benachbartes Atom etwas polarisieren - d.h. ein kleines Dipolmoment induzieren. Im Endeffekt entwickelt sich eine sehr
schwache anziehende Kraft zwischen die den induzierten Dipolen, die wiederum mit 1/r
6 abfällt. |
 |
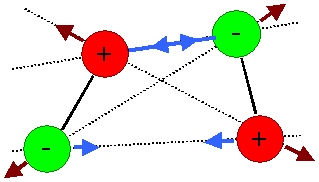
Beide Mögllichkeiten sind hier schematisch gezeigt: |
| |
 |
 |
Zwei elektrische Dipole und die einzelnen abstoßenden
und anziehenden Kräfte.
Bei der gezeigten Orientierung überwiegen
die anziehenden Kräfte. |
Das momentan polarisierte Atom 1 (der negative Ladungsschwerpunkt
der (grünen) Elektronenwolke liegt neben dem pos. Ladungsschwerpunkt des Atomkerns) ruft in dem benachbarten Atom 2
durch Induktion eine entgegengesetze Polarisation hervor.
Es resultiert eine schwache anziehende Kraft. |
|
 |
Es bleibt noch die sogenannte Wasserstoffbrückenbindung
zu besprechen. Sie sorgt nicht nur in vielen biologischen Molekülen für den Zusammenhalt zwischen Teilbereichen,
sondern ist insbesondere für die Bildung von Eis (= gefrorenes H2O) verantwortlich. |
|
 |
Am einfachsten stellt man sich die Wasserstoffbrückenbindung
als eine Unterart der Ionenbindung vor. Obwohl der Wasserstoff normalerweise kovalente Bindungen eingeht - siehe die Beispiele
im Link - wird er im Gespann mit extrem elektronegativen
Atomen - z.B. F, O und N - seines einzigen Elektrons mehr oder weniger beraubt; es wechselt weitgehend
zum elektronegativeren Element. |
|
 |
Im Extremfall eines möglichen Gedankenexperiments läge dann eine Ionenbindung vor,
bei der der positiv geladene Partner - nämlich das nur noch aus dem sehr kleinen Kern bestehende Wasserstoffion - zwei
der riesigen negativen Ionen binden kann. |
|
 |
Wir erhalten folgende Schemazeichnung |
| |
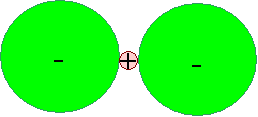 |
| Ein extrem kleines H+ - Ion mit zwei angelagerten F–
- Ionen |
|
 |
Klar ist, daß das H+ - Ion allenfalls zwei
der Riesen binden kann; für ein drittes F– oder auch O– - Ion ist kein
Platz mehr. |
|
 |
Der Extremfall der totalen Ionisierung des Wasserstoffs wird zwar in der Realität nicht
vorkommen; es reicht aber auch eine nicht 100%-ige Verschiebung des Wasserstoffelektrons um die Effekte der Wasserstoffbrückenbindung
zu erhalten. |
|
 |
Überall, wo Wasserstoff an F, O oder N hängt, gibt es damit
noch die Möglichkeit, eine relativ schwache Bindung auf der anderen Seite des H - Atoms einzugehen - es bildet
sich eine "Wasserstoffbrücke". |
|
 |
Dabei ist die Geometrie der Bindungen durch die Form der Moleküle vorgegeben. In biologischen
Substanzen sind es oft Wasserstoffbrücken, die den langen Eiweißketten ihre typische Knäuelform geben, denn
die Stellen in der Kette, an denen Wasserstoffbrücken gebildet werden können, müssen durch richtige Faltung
aufeinandertreffen. |
|
 |
Auch das gewöhnlich Eis, das jeden Winter die Umsätze der Autoreparaturwerkstätten
nach oben treibt, verdankt seine Kristallstruktur der Wasserstoffbrückenbindung. Die Moleküle des Wassers in ihrer
typischen Gestalt passen nur in ganz spezifischer Weise aneinander; sie formen einen Kristall. |
| |
| Fragebogen |
| Multiple Choice Fragen zu 2.2.4, 2.2.5, folgende |
|
© H. Föll (MaWi 1 Skript)