 |
Wir haben noch den Fall zu behandeln, daß die Atome, die sich verbinden
wollen, zuviel Elektronen haben. Damit kommen wir zur Metallbindung. |
 |
Was dann geschieht, zum Beispiel wenn sich metallisches Natrium bildet, ist einfach zu beschreiben, aber sehr schwer zu berechnen (wir
werden aber im Rahmen der Bändertheorie noch teilweise darauf zurückkommen): |
|
 |
Die Atome geben ihre überschüssigen Elektronen einfach an den entstehenden
Festkörper ab; es entsteht eine Art Elektronengas innerhalb des Körpers. In
diesem negativ geladenen Elektronengas sitzen die positiv geladenen Ionen wie die Rosinen im Teig. Obwohl sich die Ionen
abstoßen, vermittelt das negativ geladenen Kontinuum des Elektronengases eine Bindungskraft. |
 |
Betrachten wir zunächst Na
Dampf, so sehen wir (im Bild unten) einzelne Atome,
die ohne viel gegenseitige Wechselwirkung wild durcheinander fliegen. |
|
 |
Es bilden sich keine
Na - Moleküle, wie etwa beim Cl, denn die Na - Atome haben durch Bindungen mit nur einem oder
wenigen Na-Partnern nichts zu gewinnen. |
|
 |
Allenfalls werden wir ein paar Ionen und entsprechend
viel einzelne freie Elektronen finden. |
|
|
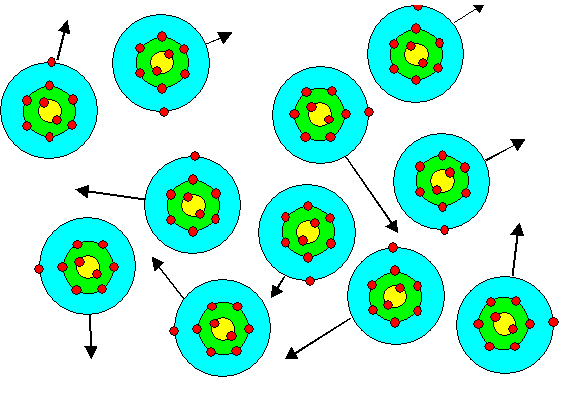 |
Schalenbild von (großen) Na - Atomen im Dampf.
Die Atome befinden sich
in lebhafter Bewegung; angedeutet durch Pfeile.
|
|
 |
Aber beim Abkühlen der vielen Na - Atome bildet sich irgendwann metallisches Na, vermittelt durch die Metallbindung, die nur im Verbund sehr vieler Atome wirkt.
Die Na - Ionen sitzen in dann regelmäßiger Anordnung in ihrem Elektronengas; allenfalls die Atome an der
Oberfläche des festen Körpers haben Probleme. |
| |
 |
Kleine Na+ - Ionenrümpfe eingebettet
in das negativ geladenene (rosa) Elektronengas.
Die Atome sitzen im Mittel fest
auf ihren Plätzen, ansonsten vibrieren sie
um die Gleichgewichtslage.
Die Elektronen sind frei beweglich
und nicht mehr einzelnen Ionen zugeordnet. |
|
 |
Die Wellenfunktionen
y der freien Elektronen haben jetzt keine Ähnlichkeit mehr mit den Orbitalen von
am Atom gebundenen Elektronen. |
|
 |
Die freien Elektronen sind offenbar überall im
Festköper mit gleicher Wahrscheinlichkeit zu finden; sie sind "ausgeschmiert". |
|
 |
Die Bindungskräfte zwischen den Atomen sind völlig ungerichtet. |
|
 |
Wiederum lassen sich die Bindungskräfte zwischen den Atomen am besten in der Näherung
der Potentialformel beschreiben, die wir schon von der Ionenbindung und der kovalenten Bindung kennen: |
| |
|
 |
Die 4 Konstanten A, B, m, n sind natürlich
für die gewählten Atome spezifisch; zwei davon lassen sich wieder durch den Bindungsabstand a0
und die Bindungsenergie EBind ausdrücken. |
 |
Wir wollen uns aber nicht weiter mit der Metallbindung beschäftigen, sondern
betrachten, nachdem wir die sogenannten sekundären Bindungen noch gestreift haben,
die Bindungen von der allgemeineren Warte der "Potentialtöpfe" aus. |
| |
| Fragebogen |
| Multiple Choice Fragen zu 2.2.4 folgende |
|
© H. Föll (MaWi 1 Skript)

