|
Es ist nicht nur lehrreich und eingängig, sondern an dieser Stelle auch sinnvoll
und weiterführend, sich zunächst die idealisierten Vorgänge bei der Ionenbindung
in abstrahierter Form graphisch vor Augen zu führen. Dazu tragen wir in ein Energie - Abstands
Diagramm die relevanten Energieverläufe ein. Wir tun das zunächst nur für die Ionen.
|
|
 |
Dabei ist als erstes die potentielle Energie der Coulombanziehung (das elektrostatische
Potential) d.h. die Energie der einen Ladung im Feld der anderen, zu
berücksichtigen. Sie muß im Unendlichen = 0 sein und für den (hypothetischen) Abstand 0 mit
1/a gegen –¥ streben. Wir können diese Kraft ohne weiteres
berechnen; sie ergibt sich aus der vorstehenden Kraftformel. Das anziehende Potential verläuft demnach mit |
| |
|
|
 |
Wobei wir die Konstante einfach mit A kennzeichnen. |
|
 |
Weiterhin müssen wir nun die Abstoßung in Betracht
ziehen, die sich ergibt, wenn sich die Ionen zu nahe kommen. Denn sobald sich die Elektronenhüllen zu nahe kommen,
oder sich gar durchdringen, sind die abstoßenden Kräfte zwischen den vielen Elektronen der inneren Schalen viel
größer als die Anziehung auf der Basis nur einer Elementarladung. |
|
 |
Genauer betrachtet müßte man jetzt Quantenmechanik treiben. Denn für die Elektronen
des Li ist im Inneren des F-Ions kein Platz. Salopp betrachtet kann man sich vorstellen, daß selbst
ohne die elektrostatische Abstoßung, die Heisenbergsche Unschärferelation
und das Pauli-Prinzip dafür sorgen, daß man nicht allzuviele Elektronen in
einem gegeben Volumen unterbringen kann |
 |
Leider haben wir keine Chance, die dadurch auftretenden Kräfte auszurechnen
oder das zugehörige Potential zu ermitteln. Aber wir können uns fragen, was wir aus allgemeinem Wissen dazu sagen
können. Das wird für alle praktischen Betrachtungen ausreichen (müssen). |
|
 |
Zunächst kann man annehmen, daß die abstoßende Kraft ziemlich ungerichtet
ist, denn die mittlere Elektronenverteilung in den Ionen ist halbwegs kugelsymmetrisch (die gerichteten p-Orbitale
sind immer gefüllt). |
|
 |
Klar ist auch, daß die abstoßende Kraft nicht spürbar ist, wenn die Ionen
sich nicht unmittelbar berühren; für a > a0 wird diese Kraft also klein sein
und mit wachsendem Abstand schnell verschwinden. |
|
 |
Genau beim Gleichgewichtsabstand wird abstoßende Kraft = Coulombkraft sein müssen,
denn a0 ist ja gerade der Abstand bei dem in Summe keine Kräfte
mehr wirken. |
|
 |
Für a < a0 wird die abstoßende Kraft steil gegen
+¥ streben. Wir wissen das aus dem tägliche Leben, denn es ist bekanntlich sehr
schwer, zwei (nichtbiologische) Körper ineinander zu schieben. Wo ein Körper ist, kann kein anderer sein, das
wußte schon Archimedes. Und das ist so, weil wir sonst
Atome auf ein Volumen konzentrieren würden, das erheblich kleiner ist, als die Summe der beiden individuellen Volumina.
Eine merkliche Volumenreduzierung und damit Dichteerhöhung ist nur bei extremsten Drücken möglich, wie sie
im Innern von manchen Sternen vorliegen. |
 |
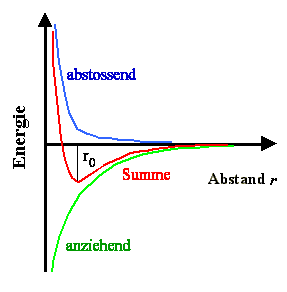
Wir können also durchaus einen ungefähren Verlauf der abstoßenden
Energie aufzeichen; auf Details wird es uns hier noch nicht ankommen. Die Überlagerung der beiden Potentialkurven wird
dann die potentielle Energie der Ionenbindung als Funktion des Abstandes darstellen. Das sieht so aus: |
| |
|
 |
Die gesamte potentielle Energie, die ein Ion bei Annäherung an das Bezugsion
spürt ergibt sich durch direkte Addition der beiden Kurven. Diese Kurve des Bindungspotentials
- man nennt diese Kurve auch Potentialtopf - ergibt sich dann automatisch so, daß: |
|
 |
Im ¥ keine Kräfte wirken. daraus
folgt, daß die Potentialkurve horizontal verläuft (Kräfte F ergeben sich aus einem Potential
U(r) immer durch Differenzieren: |
| |
| Fx | = – | dU
dx
| | Fy | = – |
dU
dy | | Fz |
= – | dU
dz |
|
|
|
 |
Da bei Annäherung an den Abstand r = 0 (entspräche der Verschmelzung
der Ionen) die abstoßende Kraft (sie muß in der gewählten Konvention ein negatives
Vorzeichen haben) extrem groß wird, muß das Potential steil nach oben laufen. |
|
 |
Beim Gleichgewichtsabstand r0 (oder a0,
wir verwenden beide Symbole), der ja so definiert ist, daß auf das Ion keine Kräfte
mehr wirken, hat das Potential ein Minimum, d.h. . |
|
|
|
|
 |
Die Tiefe des Potentialtopfes gibt dann direkt die Bindungsenergie
an. Denn die Bindungsenergie war die Arbeit, die nötig ist um das Teilchen ins ¥
zu bringen. |
 |
Um dieses Potentialtopfbild besser nutzen zu können, muß es in Formeln
gefaßt werden. Dazu fehlt nur eine Formel für das abstoßende Potential.
In einfachster, aber ausreichender (mathematischer) Näherung beschreiben
wir die Abstoßung einfach durch |
|
|
| Abstoßendes Potential = Uab | = |
B
rm |
|
|
|
 |
Dabei ist zunächst offen ist, wie groß die Parameter B und m
sind. Da aber die abstoßende Kraft sich sehr viel schneller mit r ändert als es die anziehende
tut, wird m >> 1 sein; Werte von 8 - 12 sind realistisch. |
 |
Damit erhalten wir für das Bindungspotential zweier Ionen die allgemeine Potentialformel |
| |
|
|
Vom Molekül zum Festkörper |
| |
|
 |
Wir machen jetzt gedanklich aus einem Molekül
mit Ionenbindung - z.B. wieder unser LiF - einen Festkörper (es wird automatisch
ein Kristall). |
|
 |
Dazu nehmen wir das Molekül und addieren zunächst noch ein weiteres F–
und Li+ Ion. Wir brauchen beide, wenn wir einen ungeladenen Körper produzieren wollen. |
|
 |
Um das ganze einfach zu halten, beschränken wir uns vorläufig noch auf eine eindimensionale Welt; d.h. wir können weitere Ionen nur entlang der Bindungsrichtung r
zuführen. Damit ist klar, daß wir das zweite F– Ion an das schon vorhandene Li+
Ion anlagern, und das 2.
Li+ Ion an das schon vorhandene F– Ion. |
|
 |
Das Ergebnis sieht dann so aus |
|
|
|
 |
Denken wir uns das ganze noch dreidimensional
und nehmen wir dann gedanklich irgendein Ion aus dem Kristall heraus (mathematisch geht
das; eine physikalische Umsetzung ist nicht nötig), müssen wir über alle Einzelpotentiale summieren.
|
|
 |
Statt der Formel mit den Summanden wie oben bekommen wir eine Summe mit N
- 1 Summanden, falls der Kristall aus N Ionen besteht. |
|
 |
Wie wir summieren müssen, wird dabei davon abhängen, wie die Atome räumlich
angeordnet sind. Das kann, aber muß nicht
so sein wie im Bild gezeigt. |
|
 |
Bei mit bloßem Auge sichtbaren Kristallen liegt N in der Gegend von 1020;
man kann also gleich zu ¥ viel Summanden gehen (und dann integrieren statt summieren). |
|
 |
Das ganze ist offenbar nur sinnvoll, wenn die Summen gegen
einen endlichen negativen Wert konvergieren. Das müssen sie aber, weil sonst der
Kristall nicht zusammenhalten würde. |
 |
Wenn man das alles macht, erhält man ein verblüffend
einfaches und ganz allgemeines Ergebnis. Die Potentialformel von oben ändert
sich nur ganz wenig, sie lautet jetzt |
|
|
| UBindg = |
– am
· | A
r |
+ | B
r
m |
|
|
 |
Es wird also nur der anziehende Teil durch Multiplikation mit einer Konstanten
etwas modifiziert. Der abstoßende Teil ist nicht betroffen, da die Kräfte so schnell abfallen, daß Ionen
in größerem Abstand gar nicht "gespürt" werden. |
|
 |
Die Konstante am,
die sich aus der Summation ergibt, heißt Madelungkonstante, nach dem Festkörperphysiker
Madelung. |
|
 |
Der exakte Wert der Madelungkonstanten hängt natürlich
von den Ionensorten und den damit verknüpften Bindungslängen sowie der dreidimensionalen Anordnung ab.
|
|
 |
Typische Werte für einige Ionenkristalle sind |
| |
| Kristall (Molekülformel) |
Kristalltyp (kommt später) |
Madelungkonstante am |
| NaCl | kubisch-flächenzentriert | 1,748 |
| CsCl | kubisch-raumzentriert | 1,763 | | ZnS |
kubisch-diamant | 1,638 | | ZnS | hexagonal | 1,641 |
| CaCl | kubisch-primitiv | 2,365 |
| CaF2 | kubisch-flächenzentriert | 5.039 |
| CdCl2 | hexagonal | 2,244 | | ZnO |
hexagonal | 1,498 | | SiO2 | hexagonal | 2,219 |
| Al2O3 | Rhomboedrisch | 4,172 |
|
 |
Die Ionen sind also in einem Kristall stärker gebunden als im Molekül.
Das muß auch so sein, denn sonst würde sich aus Molekülen oder Ionen nie ein Festkörper formen. |
|
 |
Stärkere Bindung (positive
Madelungkonstante) heißt ja, daß Energie frei wird, wenn sich aus einzelnen Molekülen ein Festkörper
bildet (Beim Gefrierpunkt). Und noch gehen wir davon aus, daß immer der energetisch
niedrigste Zustand begünstigt wird. |
|
 |
Eine negative Madelungkonstante würde
bedeuten, daß man Energie braucht, um einen Festkörper zu bilden - er würde also nicht stabil sein. |
 |
Wer es noch genauer wissen möchte (und vielleicht selbst probieren will,
wie leicht oder schwer es ist, Madelungkonstante auszurechnen), betätigt den Link. |
| |
|
© H. Föll (MaWi 1 Skript)