 |
In der Kochsalz oder NaCl-Struktur
kristallisieren viel Salze und Oxide, z.B. |
|
 |
KCl, AgBr, KBr, PbS,.. |
|
 |
MgO, FeO, ... |
 |
Das Gitter ist kubisch flächenzentriert,
mit zwei Atomen in der Basis; eines bei (0,0,0) und das andere bei (1/2,0,0) |
| |
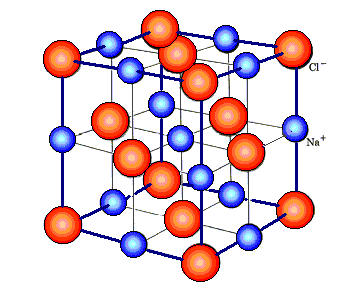 |
| NaCl - Kristallstruktur |
|
| |
|
|
|
Die CsCl - Struktur |
| | |
 |
In der Cäsiumchlorid Struktur
kristallisieren viele intermetallischen Verbindungen, aber auch Salze und andere zweiatomige Verbindungen, z.B. |
|
 |
CsCl, TlJ, ... |
|
 |
AlNi, CuZn, ... |
 |
Die CsCl - Struktur ist bemerkenswert, denn sie ist kubisch
primitiv, aber mit zwei Atomen in der Basis: eines bei (0,0,0) und
das andere bei (1/2, 1/2, 1/2). Ein beliebter Fehler ist, sie mit einem raumzentrierten Gitter zu verwechseln. |
| |
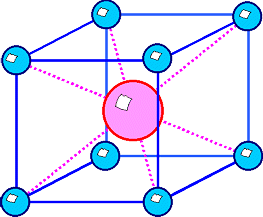 |
| Die CsCl - Struktur |
|
| |
|
|
| Die
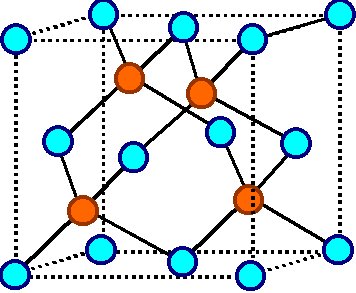
Zinkblende Struktur oder Diamant - Struktur |
| |
|
 |
Wir kennen sie schon; das fcc
- Gitter mit Atomen bei (0,0,0) und (1/4, 1/4, 1/4). Allgemein heißt dieser Kristalltyp auch ZnS- oder Zinkblende Struktur sowie (auf Englisch) gerne Sphalerite Structure. Neben der Kohlenstoffform, die man Diamant nennt, kristallisieren in dieser
Struktur Si und Ge, aber auch andere technisch wichtige Kristalle wie |
|
 |
GaAs, InSb, GaP, GaxAl1-xAs (mit Ga
und Al beliebig austauschbar). |
 |
Das folgende Bild zeigt die ZnS
Struktur. Die roten Atome könnten In sein, die blauen Sb - wir hätten
Indiumantimonid. |
|
 |
Die roten Atome könnten aber auch Ga oder Al sein, die blauen As
- wir hätten GaxAl1 – xAs. |
|
 |
Auch hier kann es leicht zu Verwechslungen kommen. Dazu machen wir eine Übung. |
| |
| |
Die ZnS - Struktur |
|
| |
|
 |
So langsam entwickeln wir die Kristallographie.
Wir wollen hier aber nicht weitermachen, obwohl es noch viel zu sagen gäbe. |
|
 |
Einige weitere wichtige Kristalltypen
finden sich im Link. |
| |
|
© H. Föll (MaWi 1 Skript)

