 |
Wir berechnen mal die Madelungkonstante für die einfachsten Ionenkristalle,
z.B. für NaCl. Wie dieser Kristall aussieht, kann man im Link
betrachten |
|
 |
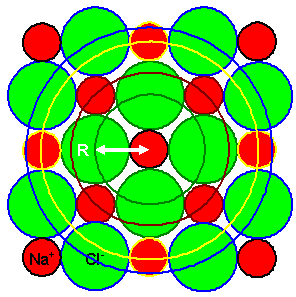
Im Zentrum des Koordinatensystem sitzt also ein Na+ Ion. Es
hat 6 Cl– ionen als nächste Nachbarn im Abstand R = a/2; dabei ist a
die Gitterkonstante. |
|
 |
Wie das halbwegs maßstabsgetreu und zweidimensional aussieht, zeigt das
folgende Bild. |
| |
|
|
 |
Die zweitnächsten Nachbarn sind dann 12 Na+ Ionen im Abstand 2½
· R. |
|
 |
Es folgen 8 Cl– ionen im Abstand 3½ · R,
dann 6 Na+ ionen im Abstand 2 · R, und so weiter und so fort. |
 |
Die zugehörigen potentiellen Energien betrachten wir uns gleich in einer
strukturierten Tabelle |
| |
| Nachbartyp | Zahl | Abstand | Typ Potential | Formel |
| 1. | 6 Cl– | R | anziehend |
| | 2. | 12 Na+ | 2½ · R |
abstoßend |
| U | = + |
e2
4pe0R
| · | 12 · 2–½ |
| | 3. | 8 Cl– |
3½ · R | anziehend |
| | 4. | 6 Na+ | 4½ · R |
abstoßend |
| | 5. | ... | ... | ... | ... |
|
 |
Damit ist die gesamte potentielle Energie |
| |
| U | = | – |
e2
4pe0R
| æ
ç
è |
6
1½ | – |
12
2½ | + |
8
3½ | – |
6
4½ |
+ ..... |
ö
÷
ø | | | |
| | | | | | |
| | | |
| | = |
– |
e2
4pe0R
| · a | | |
| | | | |
| |
|
|
 |
Der Ausdruck in der Klammer ist die Madelungkonstante a. |
|
 |
Alles, was wir noch zu tun haben ist das Bildungsgesetz der unendlichen Reihe zu finden, und
dann die mathematische Aufgabe der Aufsummierung zu lösen. |
|
 |
Das ist zwar nicht unbedingt einfach, aber machbar, und wir finden a
= 1.7476. Leider konvergiert die Summe nur langsam; die 4 oben gezeigten Terme ergeben z.B. erst – 0.866. |
 |
Für kompliziertere Kristalle wird die Berechnung der Madelungkonstanten zwar
noch nicht unbedingt zur Lebensaufgabe, aber doch zu einer anspruchsvollen mathematisch-geometrischen Übung. |
| |
|
© H. Föll (MaWi 1 Skript)
![]() 2.2.2 Vom Molekuel zum Kristall - Potentialbild und Madelungkonstante
2.2.2 Vom Molekuel zum Kristall - Potentialbild und Madelungkonstante