|
Der
erste Hauptsatz verlangt nur, daß die Energie
eines Systems ohne Einwirkung von außen konstant bleibt. Er macht aber keine Aussage
darüber, welcher von vielen möglichen Zuständen, die alle dieselbe
Energie haben, wirklich vorliegt, d. h. welcher Zustand der wahrscheinlichste ist (Siehe
auch Thermodynamik-Skript). |
|
 |
Wir haben wieder das Wort "Zustand"
- wir hatten es schon einmal als: "Der Zustand beschreibt die eine spezifische Lösung (der Schrödingergleichung) von den vielen möglichen, die beim
betrachteten Elektron greift". |
|
 |
Hier ist das nicht ganz so griffig zu definieren, aber im Grunde ist es dasselbe: Ein Zustand
des Systems ist eine der möglichen konkreten Ausformungen des Systems, die mit den Randbedingungen verträglich
ist. |
|
 |
Das läßt sich aber noch etwas schärfer fassen und differenzieren: |
 |
Jeden denkbaren Zustand, der durch dieselben
statistischen Werte für das Gesamtsystem beschrieben werden kann - z.B. durch ein und dieselbe innere Energie, dieselbe
Temperatur oder dieselbe Dichte - nennen wir einen Makrozustand. Später lernen wir
dann noch den Mikrozustand kennen. |
|
 |
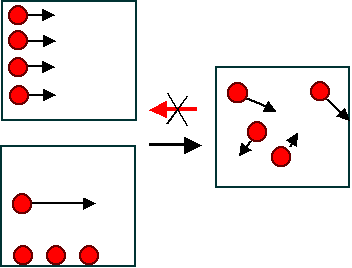
Zwei einfache Beispiele dazu: |
|
 |
 |
| Drei mögliche Makrozustände
mit derselben kinetische Energie in einem Gas |
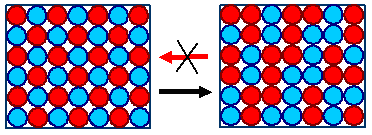
Zwei mögliche Makrozustände
mit derselben Bindungsenergie in einem zweiatomigen Kristall mit identischen Bindungsenergien
zwischen allen Atomen |
 |
Die beiden linken Makrozustände,
in der alle vier (oder in einer etwas komplexeren Zeichnung alle ca. 1024) Gasmoleküle mit gleicher
Geschwindigkeit parallel fliegen, oder sich nur ein Molekül bewegt, können
alle dieselbe Energie haben wie der rechte Makrozustand - aber sie sind offenkundig
unwahrscheinlich. |
 |
Der linke Kristall aus zwei Atomsorten ist in perfekter Ordnung. Falls
die Bindungskräfte zwischen den beiden Atomsorten wie vorausgesetzt gleich groß sind, ist dies wohl ein sehr
unwahrscheinlich Zustand. |
 |
Wahrscheinlich ist offensichtlich
der rechte Zustand. Auch wenn man mit einem unwahrscheinlichen Zustand startet, wird nach kurzer Zeit der rechte Zustand
vorliegen: Die ungeordnete Bewegung aller Moleküle. Daß aus einem solchen
Zustand von selbst einer der ordentlichen rechten Zustände entsteht, ist sehr unwahrscheinlich. |
 |
Wahrscheinlich ist der rechte Zustand der
zufälligenVerteilung der Atome.
|
 |
Falls die Bindungkräfte aber verschieden
sind, ist die Sache nicht so einfach. Dann kann auch mal der ordentliche Zustand der wahrscheinlichere sein. |
|
 |
Wieviele Beispiele man sich auch anschaut, die eher unordentlichen, chaotischen
Zustände sind meist die wahrscheinlicheren - besonders bei höherer Temperatur. Um aus vielen denkbaren Makrozuständen
den wahrscheinlichsten auswählen zu können, brauchen wir ein neues Axiom oder Naturgesetz; der 1. Hauptsatz
ist dazu offenbar nicht ausreichend. |
|
 |
Als Maß für die Wahrscheinlichkeit des Auftretens
eines Makrozustandes zur selben Energie (= Temperatur) definieren wir eine neue fundamentale Größe,
die Entropie
S des Zustands. |
|
 |
Das Wort "Entropie" stammt von Clausius, er hat es aus dem Altgriechischen
komponiert mit der Bedeutung "Verwandlung, Transformation, Wendung, Änderung". |
|
 |
Der wahrscheinlichste Makrozustand, die wahrscheinlichste Konfiguration, oder schlicht der Zustand, den wir tatsächlich finden wenn wir nachschauen, ist dann per definitionem
derjenige Makrozustand, der die größte Entropie
hat, die unter Beachtung der Randbedingungen (z.B konstante Temperatur) möglich ist. |
|
 |
Der wahrscheinlichste Makrozustand ist, bezogen auf unsere
Beispiele, auch der unordentlichste Zustand. Wir vermuten
damit schon, daß die Entropie auch ein Maß für den Ordnungsgrad
eines Zustands ist und postulieren: |
|
|
|
Je unordentlicher ein Zustand, desto größer ist seine Entropie |
|
 |
Auch ohne zu wissen, wie Entropie in Formeln, d. h. in meßbaren Parametern
definiert ist, können wir damit doch schon eine erste (qualitative) Fassung des 2.
Hauptsatzes präsentieren: |
|
|
Im thermodynamischen Gleichgewicht hat ein System eine möglichst große Entropie
und
Die Entropie eines abgeschlossenen Systems wird nie von alleine kleiner |
|
 |
Der erste Satz ist klar, der zweite Satz hat es in sich und muß erklärt
werden. |
|
 |
Der 2. Hauptsatz definiert irreversible
Prozesse: Denn ein Prozeß, bei dem die Entropie zunimmt kann offenbar
geschehen, der Rückwärtsprozeß jedoch nicht (siehe obige Gasbilder). Die Konsequenz daraus ist: |
|
 |
Der
2. Hauptsatz definiert eine Richtung der Zeitachse:
Auf der Zeitachse kann man sich nur in Richtung höherer Entropie
bewegen. Der 2. Hauptsatz ist im übrigen das einzige Naturgesetz oder Axiom,
das eine Zeitrichtung kennt. Wenn man bedenkt, wie fundamental es für uns ist, daß die Zeit immer nur in eine Richtung fließt, ist das schon sehr erstaunlich! |
|
 |
Der 2. Hauptsatz definiert den Wärmetod des
Universums: Irgendwann wird universelles Gleichgewicht im wahrsten Sinne des
Wortes, und damit maximale Unordnung erreicht sein. Nichts wird sich mehr ändern - das Universum hat den Wärmetod
erlitten. |
 |
Wir haben nun eine neue Bedingung um Gleichgewichte zu bestimmen. Nach wie vor
gilt, daß die Energie, also die innere Energie U oder die Enthalpie
H, minimal sein sollte - unser altes Prinzip
aus der klassischen Mechanik des Massenpunkts. Aber für viele Massenpunkte - für Materialien
- gilt gleichzeitig, daß die Entropie S
des Systems maximal sein soll. |
|
 |
Das ist eine komplizierte Bedingung, denn eine Verkleinerung von U kann durchaus
eine Verkleinerung von S zur Folge haben; man kann also beide Bedingungen i.d.R. nicht unabhängig voneinander erfüllen.
|
|
 |
Um beiden Bedingungen gleichzeitig zu erfüllen, definiert man am besten zwei neue Funktion,
die Energie bzw. Enthalpie und Entropie
eines Zustandes so verknüpfen, daß diese neuen Funktionen für die bestmögliche
Kombination von U (bzw. H) und S ein Minimum
haben . |
 |
Diese neuen Funktionen beschreiben damit den Zustand, d.h. den wirklich realisierten Makrozustand aus der Menge
der vielen möglichen Makrozustände des Systems; sie sind Zustandsfunktionen.
Wir wollen diesen neuen Zustandsfunktionen folgende Namen geben: |
| |
|
 |
Aus historischen Gründen heißt die freie Energie auch Helmholtz Energie, nach Hermann von Helmholtz,
einem der großen Thermodynamiker und Physiker des 19. Jahrhunderts; die freie Enthalpie heißt auch Gibbsche Energie, nach Gibbs,
einem berühmten amerikanischen Physiker. |
| |
|
Freie Energie und freie Enthalpie |
| |
|
 |
Die Thermodynamik - in der klasssischen phänomenologischen oder in der statistischen
Form - lehrt wie man zu sinnvollen Definitionen der freien Energie und Enthalpie kommt. Im Link
wird darauf eingegangen, hier machen wir uns die Sache einfach und überlegen qualitativ,
wie man diese Funktionen sinnvoll definieren könnte. |
|
 |
Ein erster naheliegender, aber (falscher!) Ansatz wäre
z.B.: |
| |
|
|
 |
Zunächst sieht das nicht so schlecht aus: F wird, wie gefordert, minimal
falls U möglichst klein und S möglichst groß ist. |
 |
Aber nach kürzerem oder längerem Nachdenken kommt man unweigerlich zu
dem Schluß: Hier fehlt noch was, nämlich die Temperatur
T. |
|
 |
Wir wissen nämlich, daß mit fallender
Temperatur die Tendenz für Ordnung zunimmt - auch wenn wir das bislang nicht angesprochen
haben! |
 |
Es genügt vollständig, sich ein x-beliebiges Material vorzustellen,
und zu überlegen was mit seinem Zustand passiert wenn man die Temperatur ändert;
z.B. von hohen Temperaturen herkommend abkühlt. |
|
 |
Aus einem unordentlichen Gas wird eine Flüßigkeit,
dann ein Festkörper; i. d. R. ein Kristall. Eine Flüßigkeit ist aber
ordentlicher als ein Gas; ein (perfekter) Kristall hätte perfekte Ordnung; und selbst ein Realkristall ist ja wohl
ein viel ordentlicheres System von Atomen als ein Gas. |
|
 |
Es gilt ganz allgemein: Mit abnehmender Temperatur steigt die Tendenz für Ordnung, mit
zunehmender Temperatur steigt die Tendenz für Unordnung; und das müssen wir berücksichtigen! |
 |
Offenbar spielt der Grad
an Unordnung, d. h. der Zahlenwert der Entropie, bei tiefen Temperaturen keine so große
Rolle mehr, während die Minimierung der Energie bei allen Temperaturen gleich wichtig
ist: Heiße und kalte Objekte fallen z.B. immer gleichschnell nach "unten". |
|
 |
Wir müssen die Entropie also mit einem Faktor gewichten, der mit der
Temperatur ansteigt. Am einfachsten ist es, schlicht die Temperatur selbst zu nehmen, also T · S
statt nur S. Damit kommen wir zur richtigen
Definition der freien Energie und Enthalpie: |
| |
F = U – T · S
G = H – T · S |
|
 |
Das sind unsere gesuchten Zustandsfunktionen,
aber sie sind mehr als das: Es sind die thermodynamischen Potentiale, die
wir bei Betrachtung des chemischen Gleichgewichts
postuliert haben. |
|
 |
Nebenbei bekommen wir die Dimension der Entropie. Da T · S
eine Energie sein muß, haben wir [S] = J · K–1. |
 |
Damit haben wir vollständig allgemeine Bedingungen für thermodynamisches
Gleichgewicht, die darüberhinaus noch extrem einfach sind (gegeben die überaus komplexe Fragestellung!!). Wir
unterscheiden aus Bequemlichkeitsgründen wie zuvor die beiden Fälle
mit konstantem Volumen bzw. konstantem Druck. Wir bekommen folgende Aussagen: |
 |
Spontane Vorgänge können
dann, und nur dann ablaufen, wenn sich bei konstantem Volumen
und gegebener Temperatur die freie Energie
F verkleinert; bei konstantem Druck und gegebener Temperatur
ist es die freie Enthalpie G. Es gilt also für spontane
Vorgänge bei konstantem Volumen bzw. Druck: |
| |
|
|
 |
Nach Atkins sind das die wichtigsten Gleichungen der (physikalischen) Chemie, und damit sind sie
auch für die Materialwissenschaft von überragender Bedeutung. |
|
 |
Spontane Vorgänge sind Vorgänge, die von
alleine, ohne äußeres Zutun ablaufen; damit sind gleichsam per definitionem Vorgänge oder Reaktionen, die
in Richtung thermodynamisches Gleichgewicht führen. |
 |
Thermodynamisches Gleichgewicht
ist dann erreicht, wenn ein Zustand mit dF = 0 bzw. dH = 0 erreicht ist, und
zwar bezüglich aller Variablen des Systems. |
|
 |
Wie das "funktioniert" sieht man sofort, wenn wir nun unser altes
Beispiel von Salz inWasser neu betrachten. |
|
 |
Da H bei der Auflösung von Kochsalz von den Teilchenzahlen abhängt,
z.B. von der Konzentration der Na+ und Cl– Ionen (nNa
und nCl), muß für das chemische Gleichgewicht bei
konst. Druck gelten: |
| |
| dGchem = |
¶G
¶nNa |
· dnNa + |
¶G
¶nCl |
· dnCl + |
¶G
¶nNaCl |
· dnNaCl = 0 |
|
|
|
 |
Für komplettes thermodynamisches Gleichgewicht bräuchten wir noch die partiellen
Ableitungen nach allen andere Variablen, z.B. (¶G/ ¶T)
· dT. Wir können aber im Gedankenversuch alle "uninteressanten" Variablen (oder "verallgemeinerte
Koordinaten") von G konstant halten, sie tauchen dann in
dG nicht mehr auf. Allerdings muß man aufpassen, denn selbst im Gedankenversuch kann man nicht immer
alles konstant halten was man nicht mag! |
|
 |
Ein Wort zur Nomenklatur: dF bezeichnet das totale Differential
von F; ¶F/¶(...) die partielle Ableitung
nach einer Variablen. Zwischen totalen Differentialen und Potentialen besteht ein enger mathematischer Zusammenhang; dies
ist im obigen Link näher ausgeführt. |
 |
Die partiellen Ableitungen sind meßbare Gößen
und damit könnte man die Gleichgewichtskonzentrationen ausrechnen - aber wir müssen noch etwas aufpassen: Unsere Variabeln sind nicht automatisch unabhängig! |
|
 |
Geht eine kleine Menge (dnNa) der Na Ionen in Lösung,
wird eine gleichgroße Menge (dnCl = dnNa) an Cl Ionen ebenfalls
in Lösung gehen müssen, sie können nicht anders. Gleichzeitig wird der
NaCl Anteil, d.h.dnNaCl, um den gleichen Betrag kleiner; wir haben |
| |
| NaCl | Û |
Na+ + Cl– |
| | |
| dnNaCl | = |
– dnNa = – dnCl |
|
|
 |
Denn die Teilchenzahlen in einem geschlossenen System sind nicht
unabhängig voneinander. |
|
 |
In unserem Beispiel muß immer ein Na+
und ein Cl– Ion in Lösung gehen (sonst würde der verbleibende
Kristall sich elektrisch aufladen), dafür gibt es dann aber ein NaCl Molekül weniger. |
|
 |
Eine allgemeine Beziehung zwischen den Teilchenzahlen läßt sich zwar formulieren,
ist aber etwas trickreich, wenn man alle Arten von Reaktionen zuläßt. Für die Atome
hätten wir zwar immer Si dni = 0, da sich die Zahl der
Atome nicht ändert, das gilt aber nicht wenn wir als Teilchen Atome und/oder Moleküle
zulassen, wie sich schon aus obigem einfachen Beispiel ergibt. |
|
 |
An dieser Stelle müssen wir das aber gar nicht so genau wissen, sondern nur zur Kenntnis
nehmen, dass aus der Reaktionsgleichung noch eine wie auch immer geartete Gleichung für die dni
resultiert. Wer's genau wissen will, betätigt den Link. |
 |
Damit haben wir als Gleichgewichtsbedingung
für das chemische oder Teilchengleichgewicht zwei gekoppelte Gleichungen
|
| |
|
 |
Wir werden auf diese Formeln noch zurückkommen; sie führen im übrigen
direkt zum (hoffentlich) allseits bekannten Massenwirkungsgsesetz
der "Chemie". |
|
 |
In Prosa sagen obige Gleichungen genau das, was wir im Unterkapitel
5.3 für das chemische Gleichgewicht postuliert hatten: |
|
|
"GG liegt dann vor, wenn es "uns" (den Na+
Ionen) egal ist, ob wir im Wasser gelöst sind oder noch zum Kristall gehören, denn dann werden im Mittel genausoviel
Na+ Ionen in Lösung gehen wie sich wieder abscheiden - die mittlere Zahl der gelösten und im
Kristall gebunden Ionen bleibt konstant" |
|
 |
In anderen Worten: Fügt man zu einem System, das chemisches Gleichgewicht erreicht hat,
bei konstantem Volumen oder Druck eine infinitesimale Menge Teilchen (dn) zu, ändert sich seine freie
Energie bzw. Enthalpie nicht, denn falls chemisches Gleichgewicht vorliegt gilt
|
| |
|
|
 |
Damit können wir auch das schon angesprochene chemische Potential etwas genauer definieren: |
 |
Das chemische Potential eines Teilchens
in einem gegebenen System (üblicherweise abgekürzt mit µ) ist die partielle Ableitung der freien Enthalpie
(bei konst. Druck) oder der freien Energie (bei konst. Temperatur) nach der Teilchenzahl (oder Konzentration) des betrachteten
Teilchens |
| |
|
|
 |
Im chemischen Gleichgewicht muß das chemische Potential eines Teilchen überall
gleich groß sein (aber nicht unbedingt = Null!) und dG ist bezüglich Änderungen
der Teilchenzahlen = Null. |
 |
Ein Wort zum Verständnis der Nomenklatur: |
|
 |
Man nennt m
chemisches Potential, obwohl chemisches Gleichgewicht nicht ein Minimum
der einzelnen chemischen Potentiale bedingt (wie beim mechanischen Gleichgewicht), sondern nur eine Art "Kräftegleichgewicht", d.h.
|
| |
| Si |
¶G
¶ni |
· dni | = |
S
mi · dni = 0 |
|
|
|
 |
Das chemische Potential ist damit eine Art Gewichtsfaktor auf der Balkenwaage
der freien Enthalpie: Falls die Summe der chemischen Potentiale der Ausgangsstoffe (z.B. NaCl) gleich der Summe der
chem. Potentiale der gebildeten Stoffe (Na+ und Cl–) ist, ist die "Waage"
im Gleichgewicht. Ein Begriff wie "Teilchenzahlfaktor" oder "Teilchenkraft" wäre eigentlich besser.
Aber es heißt nun mal "chemisches Potential" (es hat ja auch die Einheit einer Energie, nämlich eV),
und wir müssen damit leben. Sehr viel mehr dazu
im Link zum Hyperscript "Defects". |
|
 |
Das eigentliche Potential, dessen Minimum
Gleichgewicht bedingt, ist die freie Enthalpie bzw. Energie.
Diese Zustandsfunktionen heißen deshalb auch thermodynamische Potentiale. |
| |
|
Erstes Beispiel zum Umgang mit freier Enthalpie |
| |
|
 |
Betrachten wir ein erstes, rein qualitatives Beispiel für die großen
Möglichkeiten, die im Arbeiten mit freien Energien bzw. Enthalpien stecken. Wir vergleichen die freien Enthalpien eines
beliebigen Materials im festem und flüssigem
Zustand, wobei wir zunächst mal annehmen, daß beide Zustände bei allen
Temperaturen existieren könnten. |
|
 |
Wir haben konstanten Druck, die richtige Zustandfunktion ist also die freie
Enthalpie
H. Die einzige Variable, die wir zulassen, ist die Temperatur
T, wir haben also G = G(T). |
|
 |
In beiden Zuständen oder Phasen ist der Faktor T ·
S = 0 für T = 0. Da die Flüßigkeit aber der unordentlichere
Zustand ist, hat sie bei jeder endlichen Temperatur eine größere
Entropie als der feste Zustand; T · S wird von 0 beginnend für die Flüssigkeit
also schneller anwachsen müssen als für den festen Zustand. |
|
 |
Die innere Energie U, oder besser die Enthalpie H, ist im flüssigen
Zustand ebenfalls immer größer als im festen Zustand (Bindungen sind nicht
abgesättigt; die Teilchen haben kinetische Energie); in beiden Fällen wächst H irgendwie mit
T. (Nicht vergessen: T ist ein Maß für die
im System steckende Energie!). |
 |
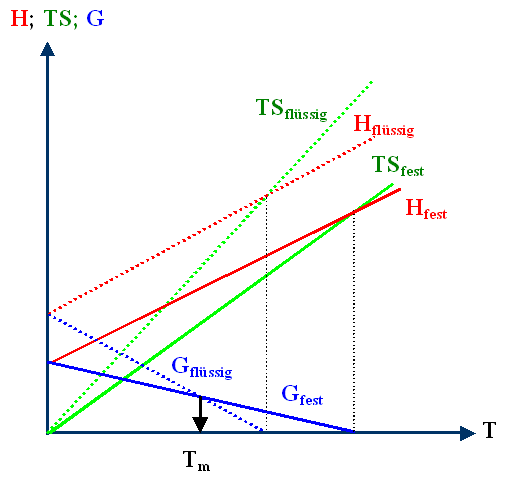
Man erhält also folgendes prinzipielles Diagramm (die blauen Kurven sind
die beiden freien Energien Gfest und Gflüssig. |
| |
|
 |
Der Einfachheit halber sind alle Kurven als Geraden gezeichnet und Schnittpunkte
für H(T) und T · S(T) eingezeichnet (damit kennt man die Nullpunkte
von G(T); angedeutet mit den gestrichelten Hilfslinien) und kann die G-Geraden leicht
zeichnen. |
|
 |
Das ist aber völlig irrelevant und vereinfacht nur die Schemazeichnung. Die Schlußfolgerung
aus diesem Diagramm gilt für alle monoton ansteigenden Funktionen, ob mit oder
ohne Schnittpunkte: |
 |
Es existiert (fast) immer eine Temperatur Tm, die Schmelzpunktstemperatur, oberhalb der die freie Enthalpie
Gflüssig der flüssigen Phase kleiner ist als Gfest der festen
Phase. Anders ausgedrückt: |
|
 |
Materialien schmelzen bzw. gefrieren,
weil in der jeweilig stabilen Phase die freie Enthalpie im Vergleich zur Alternative am kleinsten ist. Das ist eine ziemlich
weitreichende Vorhersage, die wir hier zwanglos erhalten! |
 |
Wir können noch mehr erahnen: Falls die beiden G(T)
Kurven sich so flach oder noch flacher schneiden, als in der Zeichnung angedeutet, wird
die quantitative Berechnung von Schmelzpunkten sehr schwierig sein. Denn die Lage des
Schnittpunkts zweier sich flach schneidender Geraden wird sehr stark davon abhängen, wie genau man die Geraden kennt. |
|
 |
Das ist in der Tat so; Schmelzpunkte ergeben sich aus dem Vorzeichen der Differenz
großer Zahlen. Kleinste Änderungen haben große Effekte, und die Berechnung von Schmelzpunkten aus Daten
der Atome des Materials ist nach wie vor schwierig und unbefriedigend. |
© H. Föll (MaWi 1 Skript)