 |
Zahlenwerte für die Ionisierungsenergie für praktisch alle Elemente finden sich über die Links, die vom Modul
Periodensystem ausgehen. |
|
 |
Hier sollen nur graphischeDarstellungen gezeigt werden, die insbesondere die
Trends dieser Materialparameter aufzeigen. |
|
|
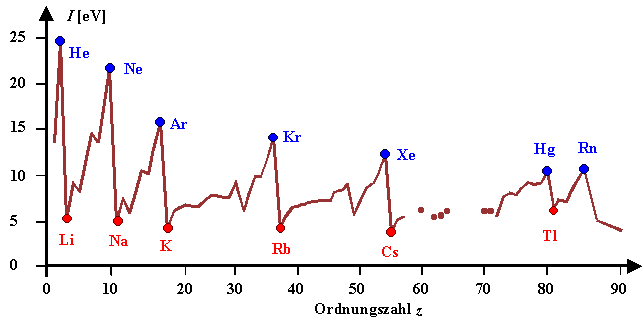 |
| Ionisierungsenergien |
|
|
 |
Wie nicht anders zu erwarten, wehren sich die Edelgase am meisten, die Alkalielemente am wenigsten,
wenn man ihnen ein Elektron wegnehmen will. |
|
 |
Außerdem wird klar, daß Cs die kleinste Ionisierungsenergie aller Elemente
hat. |
 |
Elektronenaffinitäten sind nicht ganz so einfach darzustellen |
|
 |
Hier ist eine Grafik für einige Elemente |
| |
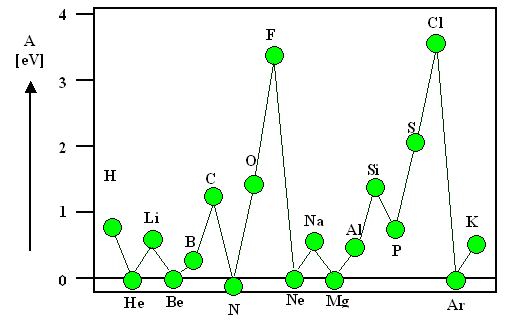 |
| Elektronenaffinitäten |
|
|
 |
Die Edelgase und einige andere Elemente sind ganz leicht im Negativen (so bei 0,2 - 0,5
eV); die höchsten Affinitäten haben natürlich die Halogene. |
|
 |
Falls man die Grafik weiterführt, kommen auch kräftige negative Werte, insbesondere
für die Erdalkali Elemente (z.B A Ca
= –1,93 eV; A Sr= –1,51 eV). |
 |
Als nächstes eine Graphik für die Elektronegativität.
Der Trend is relativ klar; die Edelgase sind nur als Referenzpunkte eingetragen (und weil aus einigen der diversen Formeln
Werte herauskommen), die Angabe einer Elektronegativität macht für sie aber nicht viel Sinn. |
| |
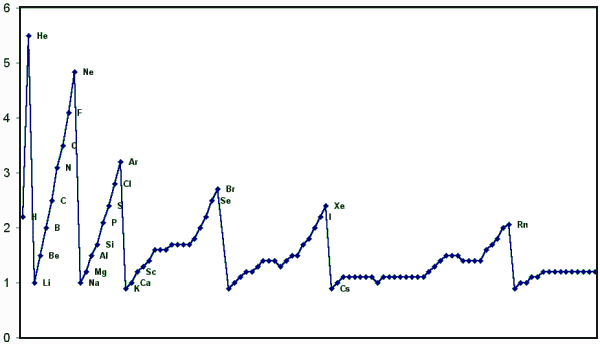 |
| Elektronegativitäten |
|
 |
Hier noch eine alternative Darstellung mit der Elektronenkonfiguration als Variable. |
| |
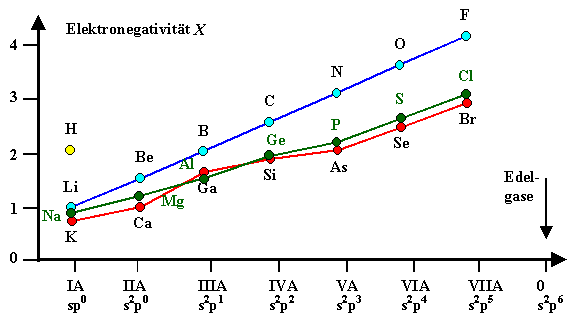 |
| Elektronegativitäten |
|
 |
Mehr zur Elektronegativität
in einem "advanced" Modul. |
|
|
© H. Föll (MaWi 1 Skript)




![]() 2.2.6 Gemischte Bindungen und allgemeine Eigenschaften
2.2.6 Gemischte Bindungen und allgemeine Eigenschaften