Berechnung der Gleichgewichts-Konzentration für einen einfachen Ionenkristall
N´=6N für Hantellage
N´=.... usw.
| Frenkel-Defekte sind wichtig bei
Ionenkristallen, sie sind wie die Schottky-Fehlordnung (s.
Kap. 2.2.3), ein Spezialfall der allgemeinen
Situation des simultanem Auftreten mehrerer verschiedener atomarer Fehlstellen.
|
|||
| Speziell ist, daß
ni=nv, d.h. immer paarweises Auftreten von
Leerstelle (V) und Zwischengitteratom (ZGA). |
|||
| Es gibt im Prinzip für jede Atomsorte den entsprechenden Frenkel-Defekt (z.B. Anion oder Kation im Zwischengitter mit der entsprechenden Leerstelle). Es tritt aber in in der Regel nur der Frenkel-Defekt mit der kleinsten Bildungsenthalpie auf. | |||
| Berechnung der Gleichgewichts-Konzentration für einen einfachen Ionenkristall |
|||
| Berechnung der Gleichgewichts-Konzentration für einen einfachen Ionenkristall, z.B. NaCl. Mit N=Zahl der pos. Ionen des Gitters, N´=Zahl der Zwischengitterplätze folgt | |||
| N´=2N für ZGA in
Tetraederlage N´=6N für Hantellage N´=.... usw. |
|||
| Die Änderung der Gibbschen Energie bei Bildung von n Frenkelpaaren ist | |||
| mit hFPund sFP als Bildungsenergie und -Entropie eines Frenkelpaars. | |||
| Aus der Gleichgewichts - Bedingung | ||
| folgt | ||
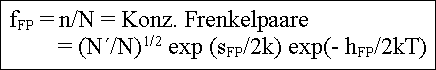
|
||
| Der Faktor 1/2 im Exponenten kommt daher, daß hFP die freie Bildungsenthalpie eines Paars und nicht die eines Einzeldefekts ist. | ||