|
Bindungspotentiale und erste Eigenschaften |
| |
| | |
| |
 |
Zwischen zwei Ionen gibt es anziehende und abstoßende Kräfte; im Gleichgewichtsabstand
r0= Bindungsabstand ist die Summe der Kräfte = 0 |
|
| U( r ) = – | r
ó
õ
r0 |
F (r') | · dr' |
| F = – | grad[ U(r)] |
= –  U(r) U(r) |
| Fx = – |
¶ U
¶x | , |
Fy = – | ¶
U
¶y |
, | Fz = – |
¶U
¶z |
|
|
|
 |
Für Ionen ist die anziehende Kraft = Coulombkraft; sie nimmt als Funktion
des Abstands r mit r–2 ab. |
|
|
 |
Über die abstoßende Kraft wissen wir nur, dass sie bei zu großer Nähe
sehr schnell sehr groß wird, d. h. mit einer Funktion wie r–m, m >>
2) anwächst. | |
 |
Statt Kräften betrachten wir aber besser das zugehörige Potential U
(r), gleich dreidimensional als Funktion des Ortsvektors r . |
|
|
 |
Das Potential der Coulombkraft hat also die Funktionalität
UCoulomb µ r–1
| |
| |
| |
| |
 |
Aus abstoßendem Potential und anziehendem Potential kann man, falls überhaupt
eine Bindung vorliegt, durch (vorzeichenrichtige) Addition immer einen Potentialtopf U(r)
konstruieren. | |
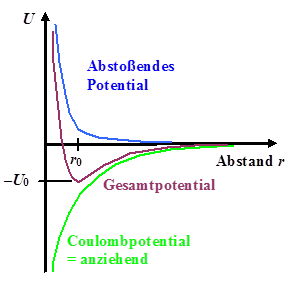 |
| Konstruktion Potentialtopf |
|
|
 |
Das abstoßende Potential wird mit B / r m
beschrieben. | |
|
 |
Das anziehende Coulombpotential wird mit –ACou / r
beschrieben; mit ACou = (q1 · q2)/(4pe0) | |
|
 |
Falls wir nicht nur die Coulomb Wechslwirkung zwischen zwei isolierten Ionen betrachten, sondern
die zwischen einem Ion in einem Ktristall und allen ( ¥ vielen) anderen, muss ACou
mit der Madelung-Konstanten a
» 1,5 ... 4,5) multipliziert werden. |
|
|
 |
Als eine allgemeine Näherungsformel mit A = a
· ACou dient dann die Gleichung |
|
|
| |
|
|
|
| |
|
| |
| |
 |
Um die Bindungsenergie zu erhalten, muss zur Tiefe des Potentialtopfes U0
noch die Energiebilanz aus Ionisierungsenergie I und Elektronenaffinität A addiert
werden, da aus den Atomen zuerst Ionen werden. | |
| XAtom + I | = |
X+Ion + e– |
| X–Ion + A | = |
XAtom + e– |
|
|
|
 |
Kleine Ionisierungsenergien liegen im Bereich von 5 eV (Alkali-Metalle), große
Elektronenaffinitäten im Bereich 3 eV (Halogene). |
|
|
| |
| |
 |
Von der Ionenbindung kommt man leicht zu jeder Bindung: sie braucht einen Potentialtopf
und kann immer in folgender Form geschrieben werden: | |
Im Bindungspotential steckt:
- Struktur des Festkörpers (Kristall, welcher Typ, ...).
- Elastizitätsmodul E.
- Thermischer Ausdehnungskoeffizient a .
- Schwingungsfrequenz der Atome im Kristall.
- Maximale Bruchfestigkeit.
- Ungefährer Schmelzpunkt.
|
|
| |
| |
| |
| |
| |
| |
|
|
 |
Von den vier Unbekannten A, B, m, n
können zwei durch die leicht zu messenden Größen U0
und r0 substituiert werden; n ist manchmal bekannt (s. o.). |
|
|
 |
Im Bindungspotential stecken viele wichtige Eigenschaften des zughörigen Kristalls |
|
|
| |
| |
 |
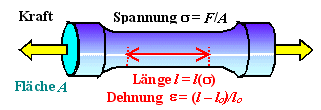
Der Elastizitätsmodul E misst die durch eine mechanische Spannung
s verursachte Dehnung e eines Materials. |
|
|
|
 |
Er ist gegeben durch | |
| |
| |
| |
| |
|
| |
| |
 |
Bindungstypen und Eigenschaften |
| |
| | |
| |
 |
Man kann vier Bindungstypen unterscheiden:
Ionische, kovalente, Metall- und Sekundärbindungen. | |
|
|
 |
Treibende Kraft für alle Bindungen ist die Möglichkeit der Energiesenkung
durch Annäherung an "abgeschlossenen" Schalen oder Orbitale (Edelgaskonfiguration) plus evtl. daraus folgende
Coulombanziehung. | |
| | |
| |
 |
Die anziehenden Kräfte der Ionenbindung
sind rein elektrostatisch. Das zugehörige Potential ist das Coulomb-Potential (mit Madelungkonstante). |
|
|
|
 |
Ionenkristalle haben typischerweise starke Bindungen, sind Nichtleiter und durchsichtig, da
keine freien Elektronen vorhanden sind. | |
| | |
| |
 |
Merke:
- Elektrische Leitfähigkeit beruht auf freien, d. h. im Kristall beweglichen Elektronen.
- Lichtteilchen, d. h. Photonen, interagieren nur mit freien Elektronen
|
| |
| | |
| |
 |
In kovalenten Bindungen "teilen"
sich die Bindungspartner einen Mangel an Elektronen. | |
|
|
 |
Sind die Elektronen in anderen als s-Orbitalen, sind die Bindungen automatisch gerichtet |
|
|
 |
Typischerweise starke bis sehr starke Bindungen. |
|
|
 |
Typischerweise keine freien Elektronen, d.h. durchsichtige Isolatoren. |
|
|
 |
Aber: Halbleiter sind meist kovalent gebunden. Freie
Elektronen entstehen durch thermische Energie und Defekte. | |
| |
| |
|
 |
In metallischen Bindungen werden überschüssige
Elektronen an den Kristall abgegeben. | |
|
|
 |
Die positiv geladenen Ionenrümpfe sitzen wie Rosinen im Teig des Elektronengases. Die
Bindungsstärke reicht von sehr schwach sein (z. B. Hg, Ga) zu sehr stark (z. B. W, Ta). |
|
|
 |
Metall haben also eine Dichte an freien Elektronen in der Größenordnung der Atomdichte. |
|
|
 |
Metalle sind leitfähig und undurchsichtig. |
|
| |
| |
| |
 |
Sekundäre Bindungen sind relativ schwach
(und ermöglichen damit "das Leben" bei Raumtemperatur). |
|
SiO2-Bindung
ionisch : kovalent » 50 : 50
gemeinsame
Elektronen sind eher beim O
Þ O ist neg. geladen |
|
|
 |
Wichtig sind Dipol-Dipol-Bindungen (Van-der-Waals-Bindungen) und die Wasserstoffbrückenbindung. |
|
 |
Im allgemeinen Fall treten Bindungen gemischt auf: |
|
| |
| |
| |
 |
Essenz der Quantentheorie |
| |
| | |
| |
 |
Für alle Rechnungen sieht das Schema so aus:
- "Input" ist das Potential U(r).
- "Output" ist die komplexe Wellenfunktion y(r)
- plus die (konstante) Gesamtenergie E.
- Die Verknüpfung von Input und Output leistet die Schrödingergleichung Þ
| |
| – |
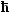 2 2
2m |
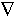 · · 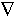 y y |
+ (U – E) y |
= 0 |
|
|
|
 |
Das Betragsquadrat y · y*
· dV gibt die Wahrscheinlichkeit
an, das behandelte Teilchen im Volumenelement dV zu finden. |
|
|
| |
| |
 |
Im allgemeinen gibt es viele (meist ¥ viele
Lösungen, die mit Quantenzahlen n, m, ... durchnumeriert werden. |
|
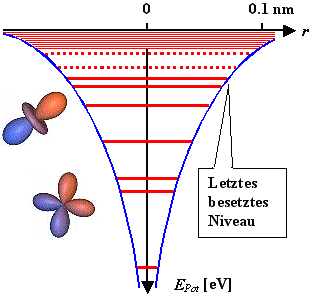 | | Die Ionisierungsenergie I ist im Bild enthalten! |
|
|
 |
Eine spez. Lösung = ein möglicher Zustand des Systems |
|
|
 |
Zu jedem Zustand yn, m, ... gehört eine
Energie En, m, ... | |
|
 |
Verschiedene Zustäden können dieselbe Energie haben. Die Energie ist dann bezüglich
der zustandsbeschreibenden Quantenzahlen entartet. |
|
 |
Was man erhält, z. B. für ein Atom, kann wieder in einem Potentialtopfmodell
visualisiert werden. | |
|
 |
Gezeigt sind zwei Wellenfunktionen = Zustände, und Energieniveaus aus den zugehörigen
E-Werten. | |
|
 |
Welche Lösungen realisiert werden (= welche Zustände besetzt werden), entscheidet
- die Natur der betrachteten Teilchen sowie
- die "Temperatur" oder die Einbettung in die "Umwelt" (in der Regel das Prinzip der Minimierung der
Energie).
| |
| | |
| |
 |
Es gibt zwei fundamentale Teilchensorten:
- Bosonen ; mit ganzzahligem Spin; z. B. Protonen, Neutronen, Photonen.
- Fermionen ; mit halbzahligem Spin; z. B. Elektronen.
|
|
Elektronen in einem
System können nie
denselben Zustand einnehmen |
|
|
 |
Für Fermionen gilt das unglaublich wichtige Pauli-Prinzip: |
|
| |
| |
| |
 |
Wichtig ist, was passiert, wenn man aus einelnen Potentialtöpfen für
Elektronen einen Kristall macht – durch Überlappung der Einzetöpfe. |
|
|
|
 |
Das Pauli-Prinzip erzwingt die Aufspaltung von überlappenden Einzelniveaus in Bänder
(bei gleichzeitiger Energieabsenkung; sonst keine Bindung!). |
|
|
 |
Wie diese Bänder genau aussehen, d.h. wieviele Plätze (= Zustände) sie Elektronen
bei der Energie E bieten, entscheidet über die wesentlichen elektronischen Eigenschaften des Materials
(Leiter, Halbleiter, Isolator, ...). | |
| | |
| |
|
| |
| Fragebogen |
| All "Multiple Choice"-Fragen zu Kapitel 2 |
|
| | |
| |
|
© H. Föll (MaWi für ET&IT - Script)