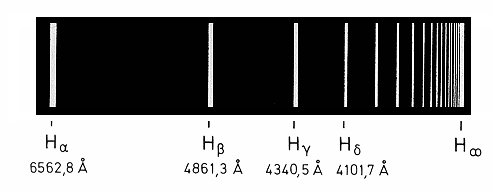
 |
|
| Linienname | n2
(n1 = 2) | l
beobachtet Å (10–10m) | l
berechnet Å (10–10m) |
| Ha | 3 | 6562,793 | 6562,78 |
| Hb | 4 | 4861,327 | 4861,32 |
| Hg | 5 | 4340,466 | 4340,45 |
| Hd | 6 | 4101,738 | 4101,735 |
| He | 7 | 3970,075 | 3970,074 |
| Hz | 8 | 3888,052 | 3888,057 |
| Hh | 9 | 3853,387 | 3835,397 |
| Hd | 10 | 3797,900 | 3797,910 |
| Hi | 11 | 3770,633 | 3770,634 |
| Hc | 12 | 3750,154 | 3750,152 |
| Hl | 13 | 3734,371 | 3734,372 |
| Hm | 14 | 3721,948 | 3721,948 |
| Hn | 15 | 3711,973 | 3711,980 |